
 环境问题已经是我国面临的重大问题.
环境问题已经是我国面临的重大问题.| 化学键 | C=0 | H-H | C-C | C-H | 0-H | C-0 |
| 键能/kJ.mol-1 | 803 | 436 | 332 | 409 | 463 | 326 |
| 成分 | 含量/(mg/L) | 成分 | 含量(mg/L) |
| Cl- | 18980 | Ca2+ | 400 |
| Na+ | 10560 | HCO3-; | 142 |
| SO42- | 2560 | Mg2+ | 1272 |
分析 I.(1)焓变等于反应物总键能减去生成物总键能;
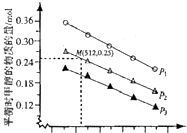
(2)当压强为P2,温度为512K时,平衡时甲醇为0.25mol,计算平衡时各组分物质的量,由于容器的容积为1L,利用物质的量代替浓度计算平衡常数,再计算此时浓度商Qc,若Qc=K,处于平衡状态,若Qc<K,反应向正反应进行,若Qc>K,反应向逆反应进行;
(3)原电池负极发生氧化反应,负极上是甲醇失去电子,碱性条件下生成碳酸根与水;
硫酸铜物质的量为0.5mol,铜离子完全放电获得电子为0.5mol×2=1mol,56L空气中氧气物质的量为$\frac{56L×0.2}{22.4L/mol}$=0.5mol,转移电子为0.5mol×4=2mol>1mol,故阴极氢离子还放电,根据电子转移守恒计算生成氢气的物质的量,阳极是氢氧根离子放电生成氧气,由电子转移守恒可知生成氧气为0.5mol;
Ⅱ.(1)Mg2+刚好沉淀完全时,溶液中c( Mg2+)=l0-5mol/L,再结合Ksp[Mg(OH)2]=c(Mg2+)×c2(OH-)=1.2×l0-11,Ksp[Ca(OH)2]=c(Ca2+)×c2(OH-)=5.5×10-6,联立计算;
(2)发生反应:I2+SO2+2H2O=H2SO4+2HI,碘反应完毕时,溶液蓝色褪去.计算通入气体总体积,根据方程式二氧化硫的体积,可得二氧化硫的含量.
解答 解:I.(1)焓变等于反应物总键能减去生成物总键能,则CO2(g)+3H2(g)?CH3OH(g)+H2O(g)的△H=[2×803+436×3-(409×3+326+463×3)]mol/L=-2208kJ/mol,
故答案为:-2208kJ/mol;
(2)当压强为P2,温度为512K时,平衡时甲醇为0.25mol,则:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
起始量(mol):1 2.75 0 0
变化量(mol):0.25 0.75 0.25 0.25
平衡量(mol):0.75 2 0.25 0.25
由于容器的容积为1L,利用物质的量代替浓度计算平衡常数,故平衡常数K=$\frac{c(C{H}_{3}OH)×c({H}_{2}O)}{c(C{O}_{2})×{c}^{3}({H}_{2})}$=$\frac{0.25×0.25}{0.75×{2}^{3}}$=$\frac{1}{96}$,
此时浓度商Qc=$\frac{0.6×2}{1×0.{5}^{3}}$=9.6>K=$\frac{1}{96}$,反应向逆反应进行,
故答案为:逆反应;
(3)原电池负极发生氧化反应,负极上是甲醇失去电子,碱性条件下生成碳酸根与水,负极电极反应式为:CH3OH+8OH--6e-=CO32-+6H2O
硫酸铜物质的量为0.5mol,铜离子完全放电获得电子为0.5mol×2=1mol,56L空气中氧气物质的量为$\frac{56L×0.2}{22.4L/mol}$=0.5mol,转移电子为0.5mol×4=2mol>1mol,故阴极氢离子还放电,根据电子转移守恒,生成氢气的物质的量为$\frac{2mol-1mol}{2}$=0.5mol,阳极是氢氧根离子放电生成氧气,由电子转移守恒可知生成氧气为0.5mol,故两极生成气体总物质的量为0.5mol+0.5mol=1mol,
故答案为:CH3OH+8OH--6e-=CO32-+6H2O;1mol;
Ⅱ.(1)Mg2+刚好沉淀完全时,溶液中c( Mg2+)=l0-5mol/L,Ksp[Mg(OH)2]=c(Mg2+)×c2(OH-)=1.2×l0-11,Ksp[Ca(OH)2]=c(Ca2+)×c2(OH-)=5.5×10-6,联立可得c(Ca2+)=4.58mol.L,
故答案为:4.58;
(2)发生反应:I2+SO2+2H2O=H2SO4+2HI,滴定终点时,溶液蓝色褪去,且半分钟不恢复颜色,通入气体总体积为ta L,由方程式可知n(SO2)=n(I2)=0.1L×0.1mol/L=0.01mol,则V(SO2)=n(I2)=0.01mol×22.4L/mol=0.224L,该处理气中SO2的含量$\frac{0.224L}{taL}$=$\frac{0.224}{at}$,
故答案为:溶液蓝色褪去,且半分钟不恢复颜色;$\frac{0.224}{at}$.
点评 本题考查反应热计算、化学平衡计算、化学平衡常数的计算和应用、原电池的工作原理、溶度积有关计算、氧化还原反应滴定等知识,属于拼合型题目,是对学生综合能力的考查,注意掌握根据平衡常数与浓度商关系判断反应进行方向.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 结构或性质信息 |
| X | 原子的L层上s电子数等于p电子数. |
| Y | 原子核外的L层有3个未成对电子. |
| Z | 在元素周期表的各元素中电负性仅小于氟. |
| M | 单质常温、常压下是气体,原子的M层上有1个未成对的p电子. |
| R | 第四周期过渡元素,其价电子层各能级处于半充满状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常见单质的沸点:W>Y>Z | |
| B. | W的氢化物为共价化合物 | |
| C. | 原子半径:Y<Z<W | |
| D. | X、Y可以形成既有极性键也有非极性键的化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
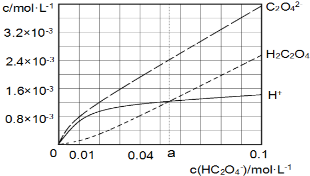 25℃时,往水中不断加入NaHC2O4固体,部分微粒浓度随c(HC2O4)的变化趋势如下图所示.下列说法正确的是( )
25℃时,往水中不断加入NaHC2O4固体,部分微粒浓度随c(HC2O4)的变化趋势如下图所示.下列说法正确的是( )| A. | 当c(HC2O4ˉ)=0.1mol•Lˉ1时,c(H+)>c(C2O42-)-c(H2C2O4) | |
| B. | 当c(HC2O4ˉ)>amol•Lˉ1时,c(H+)<c(H2C2O4),HC2O4ˉ的水解程度大于电离程度 | |
| C. | HC2O4ˉ?C2O42-+H+,Ka(HC2O4ˉ)=a | |
| D. | 将0.08mol•Lˉ1H2C2O4溶液与等浓度NaOH溶液等体积混合后(忽略体积变化),c(Na+)>c(HC2O4ˉ)>c(C2O42-)>c(H2C2O4)>c(H+)>c(OHˉ) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 有如下化学反应:2A(g)+B(g)?2C(g),△H<0.
有如下化学反应:2A(g)+B(g)?2C(g),△H<0.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 晶体熔点由低到高:CF4<CCl4<CBr4<CI4 | |
| B. | 熔点由高到低:Na>Mg>Al | |
| C. | 硬度由大到小:金刚石>碳化硅>晶体硅 | |
| D. | 四种气态氢化物按稳定性:SiH4<CH4<H2O<HF |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com