
| ||
| SO2 | O2 | SO3 | |
| 反应开始时的浓度 /mol?L-1 |
3.0 | 1.5 | 0 |
| 10min后的浓度 /mol?L-1 |
______ | ______ | ______ |
| 平均反应速率 /mol?L-1min-1 |
______ | ______ | 0.1 |
| ||
| 1 |
| 2 |
| 1 |
| 2 |
| △c(SO2) |
| △t |
| 1mol/L |
| 10min |
| △c(O2) |
| △t |
| 0.5mol/L |
| 10min |


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
| ||
| SO2 | O2 | SO3 | |
| 反应开始时的浓度 /mol?L-1 |
3.0 | 1.5 | 0 |
| 10min后的浓度 /mol?L-1 |
2.0 2.0 |
1.0 1.0 |
1.0 1.0 |
| 平均反应速率 /mol?L-1min-1 |
0.1 0.1 |
0.05 0.05 |
0.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、使用催化剂是为了加快反应速率,提高生产效率 | B、在上述条件下,SO2、O2、SO3将共存于反应体系之中 | C、当生成O2的速率与生成SO3的速率相等时达到了平衡 | D、为了提高SO2的转化率,可适当地提高O2的浓度 |
查看答案和解析>>
科目:高中化学 来源:2009-2010学年湖南省郴州市临武二中高一(下)期中化学试卷(解析版) 题型:填空题
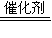 2SO3,即该反应达到一定限度后,就会在反应物和生成物之间建立一种动态平衡(即化学平衡).
2SO3,即该反应达到一定限度后,就会在反应物和生成物之间建立一种动态平衡(即化学平衡).| SO2 | O2 | SO3 | |
| 反应开始时的浓度 /mol?L-1 | 3.0 | 1.5 | |
| 10min后的浓度 /mol?L-1 | |||
| 平均反应速率 /mol?L-1min-1 | 0.1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com