
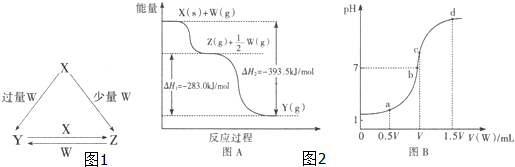
| 1 |
| 2 |
| 1 |
| 2 |


科目:高中化学 来源: 题型:
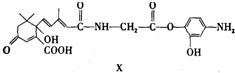
| A、X能发生氧化、取代、酯化、加聚、缩聚反应 |
| B、X与FeCl3溶液不能发生显色反应 |
| C、1mol X与足量NaOH溶液反应,最多消耗2mol NaOH |
| D、X的分子式为C23H26N2O7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、共价化合物中可能含有离子键 | ||||||
| B、Ca2+、K+、Cl-、S2-四种粒子的离子半径依次减小 | ||||||
C、
| ||||||
| D、第ⅥA族元素氧、硫、硒对应的氢化物H2O、H2S、H2Se的稳定性依次减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 酚酞,别名非诺夫他林,是制药工业原料:适用于习惯性顽固便秘,有片剂、栓剂等多种剂型,其结构如右图所示,有关酚酞说法不正确的是( )
酚酞,别名非诺夫他林,是制药工业原料:适用于习惯性顽固便秘,有片剂、栓剂等多种剂型,其结构如右图所示,有关酚酞说法不正确的是( )| A、分子式为C20H14O4 |
| B、可以发生取代反应、加成反应、氧化反应 |
| C、含有的官能团有羟基、酯基 |
| D、1mol该物质可与H2和溴水发生反应,消耗H2和Br2的最大值为10mol和4mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
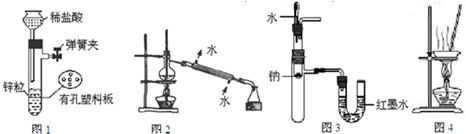
| A、用图1所示装置制取少量H2 |
| B、用图2所示装置分离Na2CO3溶液和CH3COOC2H5的混合物 |
| C、用图3所示装置验证Na和水反应的热效应 |
| D、用图4所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、CrO5中Cr元素的化合价为+10 |
| B、过氧化铬中含有极性共价键、非极性共价键和离子键 |
| C、过氧化铬是酸性氧化物,具有较强的氧化性 |
| D、上述反应每转移0.2mol电子就能生成2.24L O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、P2O5可用于干燥Cl2和NH3 |
| B、“可燃冰”主要成分是甲烷和水 |
| C、CCl4可用于鉴别溴水和碘水 |
| D、Si和SiO2都用于制造光导纤维 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com