
【题目】为确定Fe2O3和Cu混合物的组成(假设混合均匀),某兴趣小组称取五份不同质量的样品,分别投入30.0 mL某浓度的稀硫酸中。充分反应后,每组样品剩余固体的质量与原样品质量的关系如图所示。
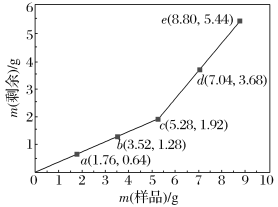
(1)n(Fe2O3)∶n(Cu)=________。
(2)稀硫酸的浓度为________。
【答案】1∶3 1.5 mol·L-1
【解析】
有固体剩余,一定不存在Fe3+,均发生反应:Fe2O3+6H+=2Fe3++3H2O、2Fe3++Cu=2Fe2++Cu2+,根据反应离子方程式中各物质的量进行求算。
有固体剩余,一定不存在Fe3+,均发生反应:Fe2O3+6H+=2Fe3++3H2O、2Fe3++Cu=2Fe2++Cu2+,
(1) 用b点数据计算:设Fe2O3为x mol,Cu为y mol
则有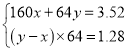
得x=0.01,y=0.03
n(Fe2O3)∶n(Cu)=1∶3。
(2)从c点曲线有一个拐点,说明硫酸全部消耗,所以可以用d数值计算。d点固体质量是b点的2倍,所以n(Fe2O3)=0.02 mol,则m(Fe2O3)=0.002 mol×160 g/mol=3.20 g,n(Cu)=0.06 mol,则m(Cu)=0.06 mol×64 g/mol=3.84 g,反应后剩余3.68 g,说明有部分Fe2O3 和Cu参加了反应,则根据Fe2O3+6H+=2Fe3++3H2O和2Fe3++Cu=2Fe2++Cu2+,设参加反应的Fe2O3的物质的量为a,则参加反应的铜的物质的量也为a,消耗的H+的物质的量为6a,则160a+64a=7.04-3.68,得a=0.015 mol,所以c(H2SO4)=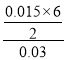 =1.5(mol·L-1)。
=1.5(mol·L-1)。


 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源: 题型:
【题目】某溶液中可能含有H+、NH4+、Fe3+、CO32-、SO42-、NO3-中的几种,且各种离子浓度相等。加入铝片,产生H2。下列说法正确的是
A. 向原溶液中加入Cu片发生:3Cu+8H++2NO3-=3Cu2++4H20+2NO↑
B. 向原溶液中加入过量氨水发生:Fe3++H++4NH3·H2O=Fe(OH)3↓+4NH4+
C. 向原溶液中加入过量Ba(OH)2溶液发生:Ba2++20H-+SO42-+NH4++H+=NH3·H2O +BaSO4↓+H2O
D. 向原溶液中加入BaCl2溶液发生:2Ba2++CO32-+SO42-=BaCO3↓+BaSO4↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2CH3OH(g)![]() CH3OCH3(g)+H2O(g) ΔH=-25 kJ·mol-1。某温度下的平衡常数为400。此温度下,在1 L体积不变的密闭容器中加入CH3OH,某时刻测得各组分的物质的量浓度如下表。下列说法中不正确的是( )
CH3OCH3(g)+H2O(g) ΔH=-25 kJ·mol-1。某温度下的平衡常数为400。此温度下,在1 L体积不变的密闭容器中加入CH3OH,某时刻测得各组分的物质的量浓度如下表。下列说法中不正确的是( )
物质 | CH3OH | CH3OCH3 | H2O |
c/mol·L-1 | 0.08 | 1.6 | 1.6 |
A. 此时刻反应达到平衡状态
B. 容器内压强不变时,说明反应达平衡状态
C. 平衡时,再加入与起始等量的CH3OH,达新平衡后CH3OH转化率不变
D. 平衡时,反应混合物的总能量降低40 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向温度为300℃的2L密闭容器中充入2molSO2和1molO2发生反应:![]() ,体系达到平衡状态后SO2的浓度为0.1mol/L,下列说法错误的是
,体系达到平衡状态后SO2的浓度为0.1mol/L,下列说法错误的是
A. 该温度下反应的平衡常数K=1620
B. SO2和O2的平衡转化率相等
C. 平衡后保持温度和容器体积不变再充入SO3(g),平衡逆向移动且平衡常数不变
D. 若不再向容器中加入任何物质,改变条件不可能使SO2的浓度达到1mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气净化反应之一:NO(g)+CO(g)![]()
![]() N2 (g)+CO 2 (g) ΔH=-373.4 kJ·mol-1。若反应在恒容的密闭容器中达到平衡状态,下列说法正确的是
N2 (g)+CO 2 (g) ΔH=-373.4 kJ·mol-1。若反应在恒容的密闭容器中达到平衡状态,下列说法正确的是
A. 及时除去二氧化碳,正反应速率加快
B. 混合气体的密度不变是该平衡状态的标志之一
C. 降低温度,反应物的转化率和平衡常数均增大
D. 其它条件不变,加入催化剂可提高反应物的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完成下列填空:
(1)与标准状况下4.48LCO2中所含氧原子数目相同的水的质量是__g;
(2)VLFe2(SO4)3溶液中含Fe3+mg,则溶液中SO42-的物质的量浓度为__mol/L;
(3)氧化铜在高温下发生分解反应:4CuO![]() 2Cu2O+O2↑,若反应过程中生成1molO2分子,则转移电子数为__。(阿伏伽德罗常数为NA)。
2Cu2O+O2↑,若反应过程中生成1molO2分子,则转移电子数为__。(阿伏伽德罗常数为NA)。
(4)在Fe+4HNO3(稀)=Fe(NO3)3+NO↑+2H2O的反应中,HNO3表现了__性和__性,则56gFe参加反应时,被还原的HNO3为__g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钴的合金及其配合物用途非常广泛。
(1) Co3+基态核外电子排布式为________。
(2) 一种Pt、Co金属间化合物可作为质子交换膜燃料电池的催化剂,其晶胞结构如图所示,该金属间化合物的化学式为________。

(3) BNCP可用于激光起爆器等,BNCP可由HClO4、CTCN、NaNT共反应制备。
①ClO4-的空间构型为________ (用文字描述)。
②CTCN的化学式为[Co(NH3)4CO3]NO3,与Co(Ⅲ)形成配位键的原子是________ (已知CO32-的结构式为![]() )。
)。
③NaNT可由![]() (双聚氰胺)为原料制备。双聚氰胺中碳原子杂化轨道类型为________,1 mol该分子中含σ键的数目为________。
(双聚氰胺)为原料制备。双聚氰胺中碳原子杂化轨道类型为________,1 mol该分子中含σ键的数目为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2O和CO是环境污染性气体,可在Pt2O+ 表面转化为无害气体,其反应原理为N2O(g) + CO(g)![]() CO2(g) + N2(g) ΔH,有关化学反应的物质变化过程及能量变化过程如下。下列说法不正确的是
CO2(g) + N2(g) ΔH,有关化学反应的物质变化过程及能量变化过程如下。下列说法不正确的是
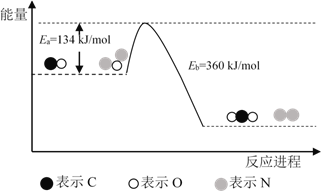
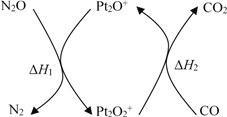
A. ΔH = ΔH1 + ΔH2
B. ΔH = 226 kJ/mol
C. 该反应正反应的活化能小于逆反应的活化能
D. 为了实现转化需不断向反应器中补充 Pt2O+ 和 Pt2O2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂的工业硫酸盐废水中含有大量的Fe2+、Fe3+、较多的Cu2+和少量的Na+。工厂计划从该废水中回收硫酸亚铁和金属铜,设计如下流程图。
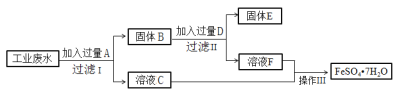
回答下列问题;
(1)A的化学式为_________,D的化学式为_______。
(2)在工业废水中加入过量A时,发应的离子方程式有:___________、__________。
(3)得到FeSO47H2O晶体的操作Ⅲ为:加热浓缩、冷却结晶、______、______、干燥。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com