
分析 向其中加入等体积的KOH溶液,混合后c(Mg2+)、c(OH-)减半,如生成沉淀,则应满足Qc>Ksp[Mg(OH)2],以此解答该题.
解答 解:可使Mg2+恰好完全沉淀,则溶液中c(Mg2+)≤1.0×10-5mol/L,设MgSO4溶液和KOH溶液体积各位VL,
则反应前n(Mg2+)=1.0×10-3Vmol,反应后体积为2V,n(Mg2+)=2.0×10-5Vmol,
△n(Mg2+)=(1.0×10-3Vmol-2.0×10-5Vmol),△n(OH-)=2×(1.0×10-3Vmol-2.0×10-5Vmol),
反应后c(OH-)=$\sqrt{\frac{1.0×1{0}^{-11}}{1.0×1{0}^{-5}}}$mol/L=1.0×10-3mol/L,
则原溶液中KOH溶液的浓度=$\frac{2×(1.0×1{0}^{-3}Vmol-2.0×1{0}^{-5}mol)+2V×1{0}^{-3}mol}{VL}$=3.96×10-3mol/L,
故答案为:3.96×10-3.
点评 本题考查了难溶物溶解平衡及其计算,为高频考点,侧重考查学生的分析能力和计算能力,题目难度中等,明确难溶物溶度积的含义及表达式为解答关键,注意镁离子完全沉淀的意义是镁离子的浓度小于或等于1.0×10-5mol/L.


 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案科目:高中化学 来源: 题型:选择题
| A. | 达到化学平衡时,4v正(O2)=5v逆(NO) | |
| B. | 若单位时间内生成xmolNO的同时,消耗xmol NH3,则反应达到平衡状态 | |
| C. | 化学反应速率关系是:2v正(NH3)=3v正(H2O) | |
| D. | 达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 少量SO2通入足量NaOH溶液中:SO2+2OH-═SO32-+H2O | |
| B. | 将氨通入稀硫酸中:NH3+H+═NH4+ | |
| C. | 在NaOH溶液中滴入NH4Cl溶液并加热:NH4+OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3+H2O | |
| D. | 向Ba(OH)2溶液中加入稀H2SO4恰好完全反应:Ba2++OH-+H++SO42-═BaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可用溴水鉴别己烯、己烷和四氯化碳 | |
| B. | 可用酸性高锰酸钾溶液除去甲烷中混有的杂质乙烯 | |
| C. | 制备氯乙烷(C2H5Cl):将乙烷和氯气的混合气放在光照条件下反应 | |
| D. |  证明溴乙烷与NaOH醇溶液共热生成乙烯:用如图所示的实验装置 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
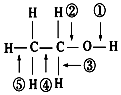
| A. | 和金属钠反应键①断裂 | |
| B. | 在铜催化下和O2反应键①③断裂 | |
| C. | 乙醇与金属钠反应比水与金属钠反应缓慢 | |
| D. | 钠与乙醇反应时,钠熔化成一个小球在乙醇表面不断的游动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 装置①是电解Na2SO4溶液联合生产硫酸和烧碱示意图,若气体甲,乙的体积比约为1:2,则离子交换膜c、d均为阴离子交换膜,产物丙为硫酸溶液 | |
| B. | 装置②是以肼(N2H4)为燃料的电池装置,a极的反应式:N2H4+4OH--4e-=N2↑+4H2O | |
| C. | 装置③是在待镀铁制品上镀铜的实验装置,电镀过程中电极Ⅱ上Cu2+放电而使溶液中Cu2+浓度逐渐变小 | |
| D. | 装置④是金属牺牲阳极的阴极保护法实验装置,加入K3[Fe(CN)6]溶液后,Fe电极附近会产生蓝色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 氰的分子式为(CN)2,分子中含有3个σ键和4个π键 | |
| B. | 甲醇(CH3OH)分子内的O-C-H键角小于甲醛(HCHO)分子内的O-C-H键角 | |
| C. | 第二周期基态原子未成对电子数与Ni相同且第一电离能最小的元素是氧 | |
| D. | 二氧化硅晶体中最小的环有3个硅原子、3个氧原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
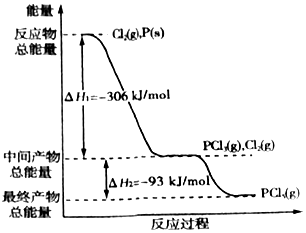 红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据).
红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com