
| 500mL |
| 50mL |
| 246g/mol×amol |
| mg |
| 246a |
| m |
| 246a |
| m |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
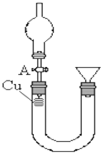 某研究性学习小组设计实验方案来研究稀硝酸与铜反应生成NO.
某研究性学习小组设计实验方案来研究稀硝酸与铜反应生成NO.查看答案和解析>>
科目:高中化学 来源: 题型:
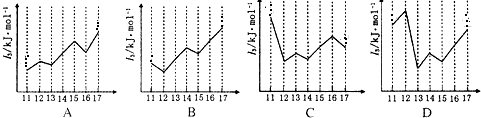
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验步骤 | 实验操作 | 现象与结论 | 离子方程式 |
| 第1步 | 取2~3mL溶液装于试管,向试管中滴加几滴KSCN溶液 | ||
| 第2步 | 若溶液紫色褪去,则溶液 含有Fe2+;若无明显变化, 则不含Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 ,则乙炔和水加成的化学方程式是
,则乙炔和水加成的化学方程式是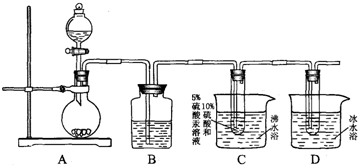
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、它是一种共价化合物 |
| B、在加热条件下不能产生有色气体 |
| C、它能与NaOH溶液反应 |
| D、该化合物中每个原子都能满足8电子稳定结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NH3通入FeSO4溶液中 |
| B、CO2通入CaCl2溶液中 |
| C、AlCl3溶液中滴入NaHCO3溶液 |
| D、SO2通入Ba(NO3)2溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、N2O |
| B、NO |
| C、N2O3 |
| D、NO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com