
【题目】A、B、C、D、E是常见化合物或单质,有如下转化关系(略去条件和副产品)。

(1)若D为氧气,C为NaAlO2,E为NaOH,则B转化为C的离子方程式为_____________。
(2)若A、B、C均为钠盐溶液且A为Na2CO3,D、E均为卤素单质且有一种为黄绿色气体,则E的化学式为_______________。
(3)若B、D均为质子数小于18的元素原子形成的单质,A、C、E均为氧化物,其中E为SiO2,且D所含元素原子的质子数是B的2倍,A转化为B、B转化为C两个反应均属于置换反应,请写出A的电子式:______________,A转化为B的化学方程式为_____________________。
【答案】 Al2O3+2OH- =2AlO2-+H2O Cl2 ![]() 2Mg+CO2
2Mg+CO2![]() 2MgO+C
2MgO+C
【解析】(1)根据题意:A 为金属铝,B为氧化铝,C为偏铝酸钠;氧化铝与氢氧化钠溶液反应生成偏铝酸钠和水;正确答案:Al2O3+2OH- =2AlO2-+H2O 。
(2)根据题意:A为碳酸钠溶液与溴水反应生成溴化钠和二氧化碳气体;溴化钠溶液与氯气反应生成氯化钠和单质溴,所以E为氯气,其化学式为Cl2;正确答案:Cl2。
(3)根据题意:能够与二氧化硅发生置换反应的是粗硅的制备:SiO2+2C=Si+2CO↑;D所含元素原子的质子数是B的2倍,所以D为Mg,能够与金属镁发生置换反应生成碳的反应为:2Mg+CO2![]() 2MgO+C;所以A为二氧化碳,电子式为
2MgO+C;所以A为二氧化碳,电子式为![]() ;正确答案:
;正确答案:
![]() ;2Mg+CO2
;2Mg+CO2![]() 2MgO+C。
2MgO+C。


科目:高中化学 来源: 题型:
【题目】由N、B等元素组成的新型材料有着广泛用途。
(1)B2H6是一种高能燃料,它与Cl2反应生成的BCl3可用于半导体掺杂工艺及高纯硅的制造;由第二周期元素组成的与BCl3互为等电子体的阴离子为_______(填离子符号,填一个)。
(2)氨硼烷(H3N→BH3)和Ti(BH4)3均为广受关注的新型化学氢化物储氢材料.
①H3N→BH3中B原子的外围电子排布图_________。
②Ti(BH4)3由TiCl3和LiBH4反应制得,写出该制备反应的化学方程式____;基态Ti3+的成对电子有___对,BH4-的立体构型是____;Ti(BH4)3所含化学键的类型有____;
③氨硼烷可由六元环状化合物(HB=NH)3通过如下反应制得:3CH4+2(HB=NH)3+6H2O→3CO2+6H3BNH3;与上述化学方程式有关的叙述不正确的是 _____________
A.氨硼烷中存在配位键
B.第一电离能:N>O>C>B
C.反应前后碳原子的轨道杂化类型不变
D.CH4、H2O、CO2都是非极性分子
(3)磷化硼(BP)是受到高度关注的耐磨材料,如图1为磷化硼晶胞;
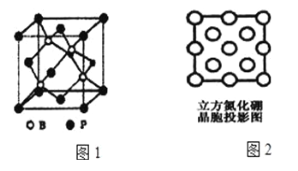
①晶体中P原子填在B原子所围成的____空隙中。
②晶体中B原子周围最近且相等的B原子有____个。
(4)立方氮化硼是一种新型的超硬、耐磨、耐高温的结构材料,其结构和硬度都与金刚石相似,但熔点比金刚石低,原因是__________。图2是立方氮化硼晶胞沿z轴的投影图,请在图中圆球上涂“●”和画“×”分别标明B与N的相对位置______。其中“●”代表B原子,“×”代表N原子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为实验室制取乙炔并验证其性质的装置图。下列说法不合理的是

A. 逐滴加入饱和食盐水可控制生成乙炔的速率
B. 用溴水验证乙炔的性质,不需要除杂
C. KMnO4酸性溶液褪色,说明乙炔具有还原性
D. 将纯净的乙炔点燃,有浓烈的黑烟,说明乙炔不饱和程度高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己烷雌酚的一种合成路线如下,下列叙述正确的是

A. 在浓硫酸加热条件下,化合物X可发生消去反应
B. 用FeCl3溶液可鉴别化合物X和Y
C. 化合物Y最多可与含6mol Br2的浓溴水发生反应
D. 化合物Y中不含有手性碳原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)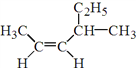 的名称是______________________________。
的名称是______________________________。
(2)![]() 中官能团的名称为______________,该物质与足量NaOH(aq)反应的化学方程式是___________________________,
中官能团的名称为______________,该物质与足量NaOH(aq)反应的化学方程式是___________________________,![]() 转化为
转化为![]() 所用试剂是________________(填化学式)。
所用试剂是________________(填化学式)。
(3)检验CH2=CHCHO中含有醛基的试剂是_______________(写一种即可),反应的化学方程式是__________________________________________。
(4)苯乙烯是一种重要的化工原料,合成苯乙烯的流程如下(A、B、C、D均为有机化合物):
 反应2的类型是____________________, 反应1的化学方程式是__________________,反应3的化学方程式是_______________________________________。
反应2的类型是____________________, 反应1的化学方程式是__________________,反应3的化学方程式是_______________________________________。
(5)写出由CH2=CH2合成CH3CH2CH2CH2OH的流程(无机试剂任选)_____。

(流程图示例:![]() )。
)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组利用如图装置,用苯与溴在FeBr3催化作用下制备溴苯:

苯 | 溴 | 溴苯 | |
密度/g·cm-3 | 0.88 | 3.10 | 1.50 |
沸点/°C | 80 | 59 | 156 |
水中溶解性 | 微溶 | 微溶 | 微溶 |
实验过程:在a中加入15mL无水苯和少量铁屑,在b中小心加入4.0mL液态溴。向a中滴入几滴溴。反应剧烈进行。反应停止后按如下流程分离提纯产品:

(1)烧瓶中有大量红棕色蒸气,试管d中的现象是:①______________;② 蒸馏水逐渐变成黄色。c的作用是___________________________________。
(2)分离提纯时,操作Ⅰ为______________,操作Ⅱ为_________________。
(3)“水洗”需要用到的玻璃仪器是_________、烧杯,向“水洗”后所得水相中滴加KSCN溶液,溶液变红色。推测水洗的主要目的是除去__________________。
(4)“NaOH溶液洗”时反应的化学方程式是________________________。
(5)已知苯与溴发生的是取代反应,推测反应后试管d中液体含有的两种大量离子是H+和Br-,设计实验方案验证推测。(限选试剂:Mg、CCl4、AgNO3aq、H2O)
实验步骤 | 预期现象 | 结论 |
步骤1:将试管d中液体转入分液漏斗, __________________________________,将所取溶液等分成两份,置于A、B两试管中,进行步骤2、3。 | ||
步骤2: 。 | 证明有 存在 | |
步骤3: 。 | 证明有 存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定条件下,下列离子组的离子共存判断及反应的离子方程式均正确的是
选项 | 条件 | 离子组 | 离子共存判断及的离子方程式 |
A |
| Fe2+、NO3-、Al3+、Cl- | 不能大量共存, 3Fe2++4H++NO3-=3Fe3++NO+2H2O |
B | 由水电离出c(H+) =1×10-13mol·L-1 | K+、NH4+、Cl-、AlO2- | 能大量共存 |
C | 含有大量Al3+的溶液 | Na+、NH4+、SO42-、Cl- | 能大量共存 |
D | 通入少量SO2气体 | K+、Na+、ClO-、SO42- | 不能大量共存, 2ClO-+SO2+H2O=2HClO+SO32- |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为T1时,在三个容积均为1L的恒容密闭容器中仅发生反应:2NO2(g) ![]() 2NO(g)+O2(g)(正反应吸热)。实验测得:v正=v(NO2)消耗=k正c2(NO2), v逆= v(NO)消耗= 2v (O2 )消耗= k逆c2 (NO)·c(O2 ),k正、k逆为速率常数,受温度影响。
2NO(g)+O2(g)(正反应吸热)。实验测得:v正=v(NO2)消耗=k正c2(NO2), v逆= v(NO)消耗= 2v (O2 )消耗= k逆c2 (NO)·c(O2 ),k正、k逆为速率常数,受温度影响。
容器编号 | 物质的起始浓度(mol/L) | 物质的平衡浓度(mol/L) | ||
c(NO2) | c(NO) | c(O2) | c(O2) | |
Ⅰ | 0.6 | 0 | 0 | 0.2 |
Ⅱ | 0.3 | 0.5 | 0.2 | |
Ⅲ | 0 | 0.5 | 0.35 | |
下列说法正确的是
A. T1时,该反应的平衡常数为1
B. 达平衡时,容器Ⅰ与容器Ⅱ中的总压强之比为 4∶5
C. 达平衡时,容器Ⅲ中 NO 的体积分数小于50%
D. 当温度改变为 T2时,若 k正=k逆,则 T2> T1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:T℃时,Ksp(CaSO4)=4.90×10-5、Ksp (CaCO3)=2.8×10-9 Ksp(PbCO3)=8.4×10-14,三种盐的沉淀溶解平衡曲线如图所示,pM=-lgc(阴离子)、pN=-lgc(阳离子)。下列说法错误的是
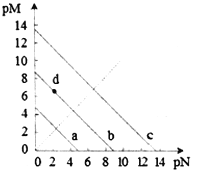
A. a线是CaSO4沉定溶解平衡曲线
B. T℃时,向10mL水中加入CaCO3和PbCO3至二者均饱和,溶液中c(Ca2+)∶c(Pb2+)=
C. d点表示CaCO3的饱和溶液。且c(Ca2+)<c(CO32-)
D. T℃时,向CaSO4沉淀中加入1mol·L-1的Na2CO3溶液,CaSO4沉淀会转化为CaCO3沉淀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com