
| A. | 乙炔 | B. | 1,3-丁二烯 | C. | 环己烷 | D. | 乙烯 |
分析 烃完全燃烧生成的产物依次通过浓硫酸和碱石灰,浓硫酸增重5.4g,碱石灰增重13.2g,n(H2O)=$\frac{5.4g}{18g/mol}$=0.3mol,n(CO2)=$\frac{13.2g}{44g/mol}$=0.3mol,烃只含C、H元素,由原子守恒及烃能使高锰酸钾褪色来解答.
解答 解:烃完全燃烧生成的产物依次通过浓硫酸和碱石灰,浓硫酸增重5.4g,碱石灰增重13.2g,n(H2O)=$\frac{5.4g}{18g/mol}$=0.3mol,n(CO2)=$\frac{13.2g}{44g/mol}$=0.3mol,烃只含C、H元素,由原子守恒可知烃的最简式为CH2,
且烃能使高锰酸钾褪色,烃含碳碳双键或三键,
B、D均含碳碳双键、且最简式为CH2,符合题意,A中最简式为CH,C中不含双键或三键,
故选BD.
点评 本题考查有机物确定的计算,为高频考点,把握原子守恒及烃的性质为解答的关键,侧重分析与计算能力的考查,注意最简式的应用,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 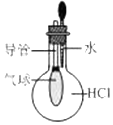 用装置验证 HCl 气体易溶于水 | |
| B. | 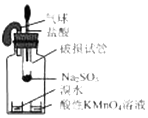 用装置验证 SO2具有漂白性 | |
| C. | 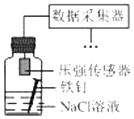 用装置采集到的压强数据判断铁钉发生析氢腐蚀还是吸氧腐蚀 | |
| D. | 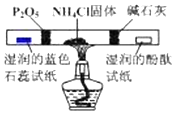 用装置检验 NH4Cl 分解产生的气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
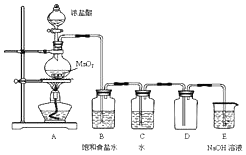 某化学兴趣小组制备饱和氯水并对饱和氯水与碳酸钙的反应进行研究.
某化学兴趣小组制备饱和氯水并对饱和氯水与碳酸钙的反应进行研究.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
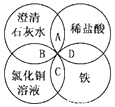 铁、稀硫酸、Ba(OH)2溶液、CuSO4溶液是中学化学常见的物质,这四种物质间的反应关系如图所示,图中两圆相交部分(A、B、C、D)表示物质之间可能发生的反应,请回答下列问题:
铁、稀硫酸、Ba(OH)2溶液、CuSO4溶液是中学化学常见的物质,这四种物质间的反应关系如图所示,图中两圆相交部分(A、B、C、D)表示物质之间可能发生的反应,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | 选用试刘 | |
| A | NaBr溶液(NaI) | 溴水 |
| B | CuCl2溶液(FeCl3) | 铜粉 |
| C | 乙烷(乙烯) | 氢气 |
| D | 溴苯(苯) | 液溴 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com