
【题目】铁的化合物有广泛用途,如碳酸亚铁(FeCO3)可作为补血剂,铁红(Fe2O3)可作为颜料。利用某硫酸厂产生的烧渣(主要含FeCO3、FeO,还有一定量的SiO2)制备碳酸亚铁的流程如图:
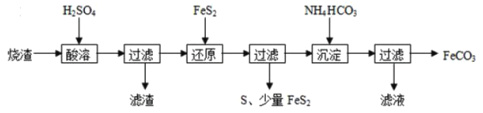
(1)“酸溶”时加快反应速率的方法有____(写出一种)。
(2)①“还原”时,FeS2与H2SO4不反应,Fe3+通过两个反应被还原,其中一个反应如下:FeS2+14Fe3++8H2O=15Fe2++2SO42-+16H+,则另一个反应的离子方程式为:___。
②FeS2还原后,检验Fe3+是否反应完全的方法是___。
(3)①“沉淀”时,需控制pH不宜过高,否则生成的FeCO3中可能混有___杂质;
②能否将NH4HCO3换成(NH4)2CO3___。
(4)FeCO3浊液长时间暴露在空气中,会有部分固体表面变为红褐色,同时释放出CO2,则与FeCO3反应的物质为___(填化学式)。
(5)FeCO3在空气中煅烧生成Fe2O3时,也会生成FeO。现煅烧34.8g的FeCO3,得到Fe2O3和FeO的混合物23.76g,则Fe2O3的质量为___g。
【答案】加热、增加硫酸的浓度、将烧渣粉碎、搅拌等 FeS2+2Fe3+=3Fe2++2S 取少量溶液,滴入几滴KSCN溶液,若溶液变为血红色,说明其中含有Fe3+,未反应完全 Fe(OH)3 能 O2、H2O 21.6
【解析】
⑴“酸溶”时加快反应速率的方法有加热、增加硫酸的浓度、将烧渣粉碎、搅拌等,故答案为加热、增加硫酸的浓度、将烧渣粉碎、搅拌等;
⑵①“还原”时,FeS2与H2SO4不反应,Fe3+通过两个反应被还原,其中一个反应如下:FeS2+14Fe3++8H2O=15Fe2++2SO42-+16H+,根据流程知,另一个反应中FeS2被氧化成S,另一个反应的离子方程式为:FeS2+2Fe3+=3Fe2++2S,故答案为FeS2+2Fe3+=3Fe2++2S;
②FeS2还原后,检验Fe3+是否反应完全的方法是取少量溶液于试管,滴入几滴KSCN溶液,若溶液变为血红色,说明其中含有Fe3+,未反应完全,故答案为取少量溶液,滴入几滴KSCN溶液,若溶液变为血红色,说明其中含有Fe3+,未反应完全;
⑶①“沉淀”时,需控制pH不宜过高,pH过高,溶液生成Fe(OH)3,故答案为Fe(OH)3;
②沉淀时主要是向硫酸亚铁溶液中加入碳酸氢铵溶液,发生Fe2+ + 2HCO3- =FeCO3↓+ CO2↑+H2O,将NH4HCO3换成(NH4)2CO3,发生离子反应为Fe2+ + CO32-= FeCO3↓,故答案为能;
⑷FeCO3浊液长时间暴露在空气中,会有部分固体表面变为红褐色,红褐色固体为氢氧化铁,同时释放出CO2,则O2、H2O与FeCO3反应方程式:4FeCO3+ O2+ 6H2O =4Fe(OH)3+ 4CO2,故答案为O2、H2O;
⑸煅烧34.8g的FeCO3,得到Fe2O3和FeO的混合物23.76g,
设氧化铁物质的量为x mol,氧化亚铁物质的量为y mol
则有160x + 72 y = 23.76, ![]() ,解得x = 0.135 ,y = 0.03,即Fe2O3的质量为21.6g,故答案为21.6 g。
,解得x = 0.135 ,y = 0.03,即Fe2O3的质量为21.6g,故答案为21.6 g。


 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:
【题目】在某无色溶液中缓慢地滴入NaOH溶液直至过量,产生沉淀的质量与加入的NaOH溶体积的关系如图所示,由此确定,原溶液中含有的阳离子是:( )

A.Mg2+、Al3+、Fe2+B.H+、Mg2+、Al3+
C.H+、Ba2+、Al3+D.只有Mg2+、Al3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸铅(PbSO4)广泛应用于制造铅蓄电池、白色颜料等。工业生产中利用方铅矿(主要成分为PbS,含有FeS2等杂质)和软锰矿(主要成分为MnO2)制备PbSO4的工艺流程如图:

已知:i.PbCl2难溶于冷水,易溶于热水。
ii.PbCl2(s)+2Cl-(aq)![]() PbCl42-(aq) ΔH>0
PbCl42-(aq) ΔH>0
iii.Ksp(PbSO4)=1.08×10-8,Ksp(PbCl2)=1.6×10-5。
(1)“浸取”时需要加热,此时盐酸与MnO2、PbS发生反应生成PbCl2和S的化学方程式为__。
(2)“调pH”的目的是__。
(3)“沉降”操作时加入冰水的作用是__。
(4)![]() 时,PbCl2(s)在不同浓度的盐酸中的最大溶解量(g·L-1)如图所示。下列叙述正确的是__(填字母)。
时,PbCl2(s)在不同浓度的盐酸中的最大溶解量(g·L-1)如图所示。下列叙述正确的是__(填字母)。

A.盐酸浓度越小,Ksp(PbCl2)越小
B.x、y两点对应的溶液中c(Pb2+)不相等
C.当盐酸浓度为1mol·L-1时,溶液中c(Pb2+)一定最小
D.当盐酸浓度小于1mol·L-1时,随着HCl浓度的增大,PbCl2溶解量减小是因为Cl-浓度增大使PbCl2溶解平衡逆向移动
(5)PbCl2经“沉淀转化”后得到PbSO4,当c(Cl-)=0.1mol·L-1时,c(SO42-)=__。
(6)“滤液a”经过处理后可以返回到__工序循环使用。利用制备的硫酸铅与氢氧化钠反应制备目前用量最大的热稳定剂三盐基硫酸铅(3PbO·PbSO4·H2O),该反应的化学方程式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物G是一种医药中间体。其合成路线如下:

(1)B中含氧官能团名称为________和________。
(2)B→C反应类型为________。
(3)D的分子式为C10H11OCl,写出D的结构简式:________。
(4)写出满足下列条件的F的一种同分异构体的结构简式:________。
①分子中含有1个苯环,能发生银镜反应;
②分子中有4种不同化学环境的氢。
(5)请以![]() 、
、![]() 和
和![]() 为原料制备
为原料制备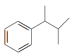 ,写出相应的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)________。
,写出相应的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na、Fe、Cl是中学化学常见的元素。回答下列问题:
(1)含上述元素的常见化合物中,呈淡黄色的是___(填化学式)。
(2)焰色反应的实验中,Na元素的焰色为___色,观察K元素的焰色需要透过___。
(3)实验室在制备Fe(OH)2时必须隔绝空气,否则发生的现象是___。
(4)MgO与碳粉和氯气在一定条件下反应可制备MgCl2,该反应的化学方程式为___。若尾气可用足量NaOH溶液完全吸收,则生成的盐为___(写化学式,只写一种)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是中学化学中常见物质的转化关系,部分物质和反应条件略去。
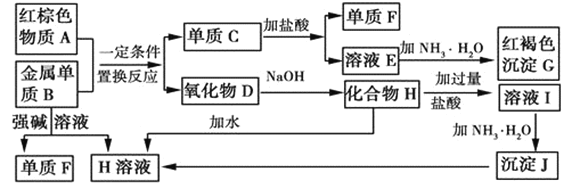
(1)单质F的化学式是___。
(2)写出由沉淀J生成 H溶液的离子方程式__。
(3)溶液E中加入氨水时,先生成白色沉淀L,写出生成L的离子方程式:__,白色沉淀L最终变为红褐色沉淀G,写出L变为G的化学反应方程式__。
(4)溶液I中所含金属离子是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值,下列说法不正确的是( )
A.标准状况下,5.6L甲烷和乙烯的混合气体中所含碳氢键数为NA
B.足量镁与一定体积的浓硫酸反应,产生气体2.24L(标准状况),则转移的电子数为0.2NA
C.含7.8gNa2S的溶液中阴离子总数大于0.1NA
D.向100mL1molL-1稀盐酸中逐滴加入含0.1molNa2CO3的溶液,则混和液中:N(CO32-)+N(HCO3-)+N(H2CO3)=0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向10 mL某浓度的AlCl3溶液中滴加1.5 mol·L-1的NaOH溶液时,得到Al(OH)3沉淀的质量(g)与所滴加NaOH溶液的体积(mL)关系如图所示,试回答下列问题:
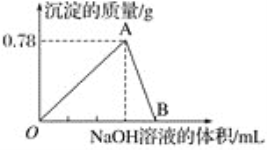
(1)图中B点溶液中的溶质有________________。
(2)O点到B点反应的总离子方程式可表示为________________。
(3)反应至A点时消耗NaOH溶液的体积为______________。
(4)AlCl3溶液的浓度为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室欲用NaOH固体配制1.0 mol·L-1的NaOH溶液240 mL:
(1)配制溶液时,一般可以分为以下几个步骤:
①称量 ②计算 ③溶解 ④摇匀 ⑤转移 ⑥洗涤 ⑦定容 ⑧冷却 ⑨摇动
其正确的操作顺序为__________________。必须用到的玻璃仪器有烧杯、胶头滴管、________________。
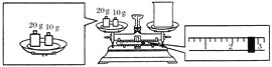
(2)某同学欲称量NaOH的质量,他先用托盘天平称量烧杯的质量,天平平衡后的状态如图所示。烧杯的实际质量为________ g,要完成本实验该同学应称出________ g NaOH。
(3)使用容量瓶前必须进行的一步操作是________。
(4)如图是该同学转移溶液的示意图,图中有两处错误,请写出:
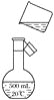
①________________________________________________________________________
②________________________________________________________________________
(5)在配制过程中,其他操作都是正确的,下列操作会引起误差偏高的是________(填字母)。
A.所用NaOH已经潮解
B.向容量瓶中加水未到刻度线
C.有少量NaOH溶液残留在烧杯里
D.用带游码的托盘天平称5.4 g NaOH(1 g以下用游码)时误用了“左码右物”方法
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com