
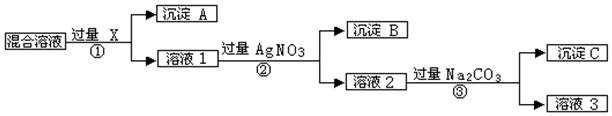
分析 如先加入AgNO3,则会同时生成Ag2SO4和AgCl沉淀,则应先加入过量的BaCl2[或Ba(NO3)2],生成BaSO4沉淀,然后在滤液中加入过量的AgNO3,使Cl-全部转化为AgCl沉淀,在所得滤液中加入过量的Na2CO3,使溶液中的Ag+、Ba2+完全沉淀,最后所得溶液为NaNO3和Na2CO3的混合物,加入稀HNO3,最后进行蒸发操作可得固体NaNO3.
(1)上述分析可知试剂X为BaCl2[或Ba(NO3)2],沉淀A为BaSO4,沉淀B为AgCl;
(2)加入过量的BaCl2[或Ba(NO3)2],然后在滤液中加入过量的AgNO3,使Cl-全部转化为AgCl沉淀,在所得滤液中含有Ag+、Ba2+,在所得滤液中加入过量的Na2CO3,使溶液中的Ag+、Ba2+完全沉淀;
(3)溶液3为NaNO3和Na2CO3的混合物,加入稀HNO3,可除去Na2CO3;
解答 解:(1)如先加入AgNO3,则会同时生成Ag2SO4和AgCl沉淀,则应先加入过量的BaCl2[或Ba(NO3)2],生成BaSO4沉淀,然后在滤液中加入过量的AgNO3,使Cl-全部转化为AgCl沉淀,则试剂X为BaCl2[或Ba(NO3)2],沉淀A为BaSO4,沉淀B为AgCl,
故答案为:BaCl2[或Ba(NO3)2];BaSO4;AgCl;
(2)加入过量的BaCl2[或Ba(NO3)2],然后在滤液中加入过量的AgNO3,使Cl-全部转化为AgCl沉淀,在所得滤液中含有Ag+、Ba2+,在所得滤液中加入过量的Na2CO3,使溶液中的Ag+、Ba2+完全沉淀,反应的化学方程式为:Ba(NO3)2+Na2CO3=BaSO4↓+2NaNO3,2 AgNO3+Na2CO3=Ag2CO3↓+2NaNO3,
故答案为:除去过量的Ba(NO3)2〔或BaCl2〕和AgNO3,Ba(NO3)2+Na2CO3=BaSO4↓+2NaNO3;2 AgNO3+Na2CO3=Ag2CO3↓+2NaNO3.
(3)溶液3为NaNO3和Na2CO3的混合物,加入稀HNO3,可除去Na2CO3,最后加热蒸发、冷却结晶、过滤得到硝酸钠,
故答案为:在溶液3中加入稍过量的稀硝酸,然后加热蒸发结晶;
点评 本题考查物质的分离提纯操作,题目难度中等,本题注意Cl-、SO42-的性质,把握除杂原则,提纯时不能引入新的杂质,注意把握实验的先后顺序.


 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:选择题
| A. | N2$→_{放电}^{O_{2}}$NO2$\stackrel{H_{2}O}{→}$HNO3 | |
| B. | MnO2$→_{△}^{浓盐酸}$Cl2$\stackrel{石灰水}{→}$漂白粉 | |
| C. | 黄铁矿$→_{煅烧}^{沸腾炉}$SO2$→_{O_{2}}^{接触室}$SO3$→_{水}^{吸收塔}$稀硫酸 | |
| D. | 铝土矿$→_{过滤}^{NaOH溶液}$NaAlO2溶液$→_{过滤}^{CO_{2}}$Al(OH)3$\stackrel{△}{→}$Al2O3$\stackrel{电解}{→}$Al |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同温同压下,相同体积的物质,它们的物质的量相同 | |
| B. | 常温常压下,等质量的N2与CO所含分子数相同 | |
| C. | 同温同体积下,同质量的H2与O2的压强比约为1:16 | |
| D. | A容器中的H2与B容器中的NH3所含原子总数相等,则两容器的体积比为2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | D2O分子中氧原子为sp3杂化 | |
| B. | Cr原子价电子排布式:3d54s1 | |
| C. | 硫离子的核外电子排布式:1s22s22p63s23p6 | |
| D. | S原子的电子排布图: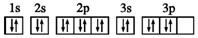 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 将含有少量CO2的CO通入足量Na2O2的试管中并不断用电火花引燃 | |
| B. | 向等物质的量的干冰和CaO的混合物中加几滴水 | |
| C. | 在强光持续照射下,向过量的Ca(ClO)2浊液中通入少量的CO2 | |
| D. | 将1molCu置于含2molH2SO4的浓溶液中加热 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com