
| A、产生H2体积相等 |
| B、铝产生H2最多,钠产生H2最少 |
| C、钠产生H2最多,铝产生H2最少 |
| D、钠产生H2最多,镁、铝产生H2相等 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |


科目:高中化学 来源: 题型:
| A、反应后的溶液中:c(Na+)>c(CH3COO-) | ||
| B、反应前溶液的物质的量浓度:m=n | ||
| C、反应后的溶液中:c(CH3COO-)+c(CH3COOH)=m mol?L-1 | ||
D、该温度下,醋酸的电离平衡常数的表达式为:Ka=
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出 |
| B、蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口 |
| C、蒸发结晶时不应将溶液直接蒸干 |
| D、食盐应放在滤纸上称量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 和 和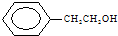 |
| B、最简式相同的有机物 |
| C、丙酸丙酯和高级脂肪甘油脂 |
| D、分子组成为CnH2n+2和CmH2m+2(m≠n)的两种烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、导电性很强的物质,在任何情况下均能导电 |
| B、在溶于水或熔融状态下能导电的化合物 |
| C、在溶于水或熔融状态下全部电离的化合物 |
| D、可溶性盐类、酸类和碱类等化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CaCl2=Ca2++2Cl- |
| B、NaHSO4=Na++H++SO42- |
| C、H2CO3=2H++CO32- |
| D、HNO3=H++NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:

 (g)+CO2(g)?
(g)+CO2(g)?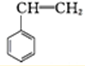 (g)+CO(g)+H2O(g)的△H=
(g)+CO(g)+H2O(g)的△H= )的影响,并设计了如下实验:
)的影响,并设计了如下实验:| 试验编号 | 乙苯 | CO(g)/mol | H(g)/mol | 温度/℃ |
| Ⅰ | 3.0 | 9.0 | 0 | 550 |
| Ⅱ | 3.0 | 9.0 | 0 | 600 |
| Ⅲ | 3.0 | 0 | 9.0 | 550 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com