
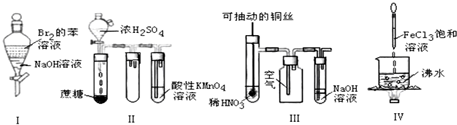
| A. | 实验Ⅰ:振荡后静置,上层溶液颜色保持不变 | |
| B. | 实验Ⅱ:酸性KMnO4溶液中出现气泡,且颜色逐渐褪去 | |
| C. | 实验Ⅲ:微热稀HNO3片刻,溶液中有气泡产生,广口瓶内始终保持无色 | |
| D. | 实验Ⅳ:向沸水中滴加FeCl3溶液,继续煮沸溶液至红褐色,就可以制备FeCl3胶体 |
分析 A.振荡后静置,Br2与NaOH发生反应:Br2+2NaOH=NaBr+NaBrO+H2O,反应后的物质的水溶液都无色;
B.浓硫酸有脱水性和强氧化性,反应产生的气体中含有CO2、SO2,SO2有还原性,能够使酸性KMnO4溶液被还原而使溶液褪色,CO2不能反应从溶液中逸出;
C.Cu与稀硝酸发生反应:3Cu+8HNO3(稀)=2Cu(NO3)2+2NO↑+4H2O,反应产生的NO遇空气会发生反应:2NO+O2=2NO2;
D.制备氢氧化铁胶体时应该用饱和氯化铁溶液.
解答 解:A.实验I:振荡后静置,Br2与NaOH发生反应:Br2+2NaOH=NaBr+NaBrO+H2O,反应后的物质的水溶液都无色,因此上层溶液颜色变浅甚至几乎无色,故A错误;
B.实验II,浓硫酸有脱水性和强氧化性,反应产生的气体中含有CO2、SO2,SO2有还原性,能够使酸性KMnO4溶液被还原而使溶液褪色,CO2不能反应从溶液中逸出,因此酸性KMnO4溶液中出现气泡,且颜色逐渐褪去,故B正确;
C.实验III中,Cu与稀硝酸发生反应:3Cu+8HNO3(稀)=2Cu(NO3)2+2NO↑+4H2O,反应产生的NO遇空气会发生反应:2NO+O2=2NO2,气体由无色变为红棕色,故C错误;
D.实验IV:向沸水中滴加饱和FeCl3溶液,继续煮沸溶液至液体呈红褐色,就制备得到Fe(OH)3胶体,故D错误;
故选B.
点评 本题考查化学实验方案评价,为高频考点,涉及物质制备、浓硫酸性质、硝酸性质、物质分离和提纯等知识点,明确实验原理及物质性质是解本题关键,物质检验时要排除其它物质的干扰,题目难度不大.


 灵星计算小达人系列答案
灵星计算小达人系列答案科目:高中化学 来源: 题型:选择题
| R | T | |
| X | Y | Z |
| A. | 气态氢化物稳定性:Y>T | |
| B. | R能分别与X、Z形成共价化合物 | |
| C. | R位于元素周期表中第二周期第VA族 | |
| D. | Z元素的最高价氧化物对应的水化物的化学式为HZO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “西气东输”中的“气”指的是煤气 | |
| B. | 我国使用最早的合金为青铜,主要成分是 Cu 和 Sn | |
| C. | 自然界存在大量游离态的硫及硅 | |
| D. | 氮是动植物生长不可缺少的元素,是油脂的组成元素之一 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题


 ,D中官能团的名称为碳碳双键、溴原子.
,D中官能团的名称为碳碳双键、溴原子. .
. .
.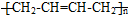 )的合成路线:CH3CH2CH2CH2OH$→_{△}^{浓硫酸}$CH3CH2CH=CH2$\stackrel{NBS}{→}$CH3CHBrCH=CH2$→_{△}^{NaOH醇溶液}$CH2=CHCH=CH2
)的合成路线:CH3CH2CH2CH2OH$→_{△}^{浓硫酸}$CH3CH2CH=CH2$\stackrel{NBS}{→}$CH3CHBrCH=CH2$→_{△}^{NaOH醇溶液}$CH2=CHCH=CH2 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 已知A、B、C、D、E、F、G七种元素,它们的原子序数依次增大.A在所有元素中原子半径最小;B原子核外电子有6种不同运动状态;D与C、E均相邻;A、D、E三种元素的原子序数之和为25;E2-和F+有相同的核外电子排布;G的质子数是25.请回答下列问题:
已知A、B、C、D、E、F、G七种元素,它们的原子序数依次增大.A在所有元素中原子半径最小;B原子核外电子有6种不同运动状态;D与C、E均相邻;A、D、E三种元素的原子序数之和为25;E2-和F+有相同的核外电子排布;G的质子数是25.请回答下列问题: 或
或 (任写一种).
(任写一种).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
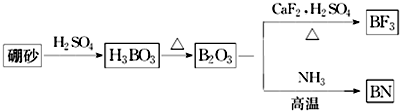
 ,并推测1mol NH4BF4(氟硼酸铵)中含有2NA个配位键.
,并推测1mol NH4BF4(氟硼酸铵)中含有2NA个配位键.
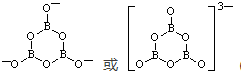 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 电极Ⅰ发生还原反应 | B. | 电流方向:电极Ⅳ→ →电极Ⅰ →电极Ⅰ | ||
| C. | 电极Ⅱ逐渐溶解 | D. | 电极Ⅲ的电极反应:Cu2++2e-═Cu |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com