
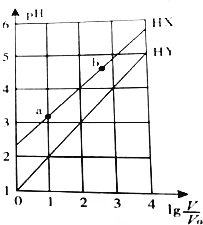
| A. | HX、HY都是弱酸,且HX的酸性比HY的弱 | |
| B. | 常温下,由水电离出的c(H+)•c(OH-):a<b | |
| C. | 相同温度下,电离常数K( HX):a>b | |
| D. | lg$\frac{V}{{V}_{0}}$=3,若同时微热两种溶液(不考虑HX、HY和H2O的挥发),则$\frac{c({X}^{-})}{c({Y}^{-})}$减小 |
分析 A.根据图知,lg$\frac{V}{{V}_{0}}$=0时,HX的pH>1,说明HX部分电离为弱电解质,HY的pH=1,说明HY完全电离,为强电解质;
B.酸或碱抑制水电离,酸中氢离子浓度越小其抑制水电离程度越小;
C.相同温度下,酸的电离平衡常数不变;
D.lg$\frac{V}{{V}_{0}}$=3,若同时微热两种溶液(不考虑HX、HY和H2O的挥发),n(X-)增大,n(Y-)不变,二者溶液体积相等.
解答 解:A.根据图知,lg$\frac{V}{{V}_{0}}$=0时,HX的pH>1,说明HX部分电离为弱电解质,HY的pH=1,说明HY完全电离,为强电解质,HY的酸性大于HX,故A错误;
B.酸或碱抑制水电离,酸中氢离子浓度越小其抑制水电离程度越小,根据图知,b溶液中氢离子浓度小于a,则水电离程度a<b,所以由水电离出的c(H+)•c(OH-):a<b,故B正确;
C.酸的电离平衡常数只与温度有关,所以相同温度下,电离常数K( HX):a=b,故C错误;
D.lg$\frac{V}{{V}_{0}}$=3,若同时微热两种溶液(不考虑HX、HY和H2O的挥发),n(X-)增大,n(Y-)不变,二者溶液体积相等,所以$\frac{\frac{n({X}^{-})}{V}}{\frac{n({Y}^{-})}{V}}$=$\frac{c({X}^{-})}{c({Y}^{-})}$变大,故D错误;
故选B.
点评 本题考查弱电解质电离,为高频考点,侧重考查学生分析推断及识图能力,正确判断两种酸的强弱是解本题关键,注意:酸的电离平衡常数只与温度有关,与溶液浓度无关,易错选项是D.


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、OH-、HCO3- | B. | Ag+、Fe3+、Cl- | C. | NH4+、K+、OH- | D. | Ba2+、OH-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
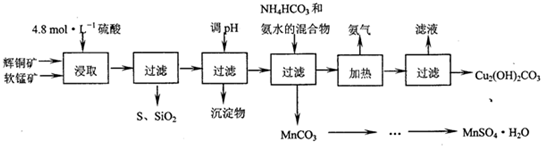
| 开始沉淀的PH | 沉淀完全的PH | |
| Fe3+ | 1.1 | 3.2 |
| Mn2+ | 8.3 | 9.8 |
| Cu2+ | 4.4 | 6.4 |
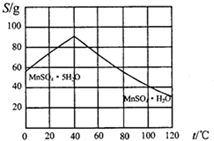
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHS03溶液显酸性:HS03-═H++S032- | |
| B. | 苯酚钠溶液中通入少量C02: C6H50+CO2+H20→C6H50H+HCO3- | |
| C. | 强碱性溶液中次氯酸钠溶液与Fe(OH)3反应生成Na2FeO4:3ClO-+2Fe(OH)3═2Fe042-+3Cl-+H20+4H+ | |
| D. | 向 Ca(Cl0)2 溶液中通入过量 S02:Ca2++2C10-+SO2═CaSO4↓+2Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 2min | 4min | 6min | 8min | ′′′ | |
| CO | 0.07 | 0.06 | 0.04 | 0.05 | ′′′ |
| H2 | x | 0.12 | 0.12 | 0.2 | ′′′ |
| CH2OH | 0.03 | 0.04 | 0.04 | 0.05 | ′′′ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2SO4 KNO3 Na2CO3 NH4Cl | B. | H2SO4 BaCl2 Na2SO4 NaOH | ||
| C. | MgCl2 AgNO3 KNO3 HCl | D. | NH4HCO3 NaOH NaCl HCl |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com