
| A、1 mol O2和1 mol N2所占的体积都约为22.4 L |
| B、H2的气体摩尔体积约为22.4 L |
| C、在标准状况下,1 mol H2和1 mol H2O所占的体积都约为22.4 L |
| D、在标准状况下,22.4 L由N2、N2O组成的混合气体中所含有的N的物质的量约2 mol |
| V |
| Vm |
| V |
| Vm |
| 22.4L |
| 22.4L/mol |


科目:高中化学 来源: 题型:
| A、如果M溶液呈强酸性,则N溶液中可能含有的阴离子有:OH-、NO3-、CO32- |
| B、如果M溶液呈强碱性,则N溶液中可能含有的阴离子有:MnO4-、AlO2-、SO42- |
| C、如果M溶液具有强还原性,则N溶液中可能含有的阴离子有:MnO4-、NO3-、SO42- |
| D、如果M溶液具有强氧化性,则N溶液中可能含有的阳离子有:K+、Na+、NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、3:2 | B、2:5 |
| C、3:5 | D、5:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
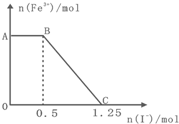 已知酸性高锰酸钾溶液可以将FeSO4氧化,化学反应方程式为:
已知酸性高锰酸钾溶液可以将FeSO4氧化,化学反应方程式为:| A、图中AB段主要是高锰酸钾和碘化钾溶液反应 | ||||
| B、图中BC段发生的反应为2Fe3++2I-═2Fe2++I2通电 | ||||
| C、根据OC段的数据可知开始加入的高锰酸钾的物质的量为0.25mol | ||||
D、以Pt为电极材料电解C点的溶液,总反应式为2H2O
|
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、洗气或干燥装置:瓶内放一定体积溶液,由a进气 |
| B、用于收集氢气:瓶内充满水,由b进气 |
| C、排空气收集H2:瓶内充满空气,由a进气 |
| D、病人输氧时用于观察输氧速度:瓶内装适量水,b接病人鼻腔 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、FeSO4 |
| B、Na2CO3 |
| C、KNO3 |
| D、KCl |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com