
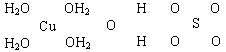
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
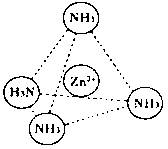

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 以上信息,回答下列问题:
以上信息,回答下列问题: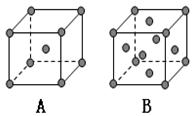
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 表示,阴离子B以
表示,阴离子B以 表示。
表示。
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.炼铁 | B.炼铝 | C.制发烟硫酸 | D.合成氨 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.氯化铯晶体中,每1个Cs+与其他8个Cs+等距离紧邻 |
| B.金刚石网状结构中,由共价键构成的碳原子环中,最小的环上有4个碳原子 |
| C.熔点由高到低的顺序是:金刚石>碳化硅>晶体硅 |
| D.PCl3和了BCl3分子中所有原子的最外层都达到8电子稳定结构 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.干冰升华时分子内共价键会发生断裂 |
| B.原子晶体中原子以共价键结合,具有键能大、熔点高、硬度大的特性 |
| C.分子晶体的熔沸点低,常温下均呈液态或气态 |
| D.金属导电的原因是在外加电场的作用下金属产生自由电子,电子定向运动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com