
【题目】氮和氮的化合物在国防建设、工农业生产和生活中都有极其广泛的用途。请回答下列与氮元素有关的问题:
(1)NaCN广泛用于电镀工业上,实验测得浓度相同的NaCN溶液和NaHCO3溶液,前者的pH大,则酸性:HCN___________H2CO3(填“强于”或“弱于”)。
(2)亚硝酰氯(结构式为Cl-N=O)是有机合成中的重要试剂。它可由C12和NO在通常条件下反应制得,反应方程式为:2NO(g)+Cl2(g)![]() 2ClNO(g)。已知几种化学键的键能数据如下表:
2ClNO(g)。已知几种化学键的键能数据如下表:

当Cl2与NO反应生成ClNO的过程中转移了5mol电子,理论上热量变化为___________kJ。
(3)在一个恒容密闭容器中充入2 mol NO(g)和1molCl2(g)发生(2)中反应,在温度分别为T1、T2时测得NO的物质的量(单位:mol)与时间的关系如下表所示:

①T1___________T2(填“>”“≤”或“=”),理由是___________。
②若容器容积为1L,温度为T1℃时,反应开始到5min时,C12的平均反应速率为_______。
③温度为T2℃时,在相同容器中,充入1 molNO(g)和0.5mo1Cl2(g),则NO的平衡转化率___________50%(填“大于”、“等于”或“小于”)
④温度为T2℃时,起始时容器内的压强为p0,则该反应的平衡常数Kp=___________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(4)近年来,地下水中的氮污染已成为一个世界性的环境问题。在金属Pt、Cu和铱(Ir)的催化作用下,密闭容器中的H2可高效转化酸性溶液中的硝态氮(NO3-),其工作原理如图所示:

①Ir表面发生反应的方程式为___________。
②若导电基体上的Pt颗粒增多,造成的结果是___________。
【答案】弱于 277.5 < 因为该反应的正反应为放热反应,温度越高,达平衡时的转化率越低(或温度越高,反应速率快,在达到平衡前,单位时间内消耗NO的量越多) 0.05mol/(L·min) 小于 ![]() H2+N2O==N2+H2O 不利于降低溶液中的含氮量
H2+N2O==N2+H2O 不利于降低溶液中的含氮量
【解析】
(1)强碱弱酸盐,越弱水解程度越大;
(2)根据焓变=反应物总键能-生成物总键能计算2NO(g)+Cl2(g)![]() 2ClNO(g)反应的焓变,转移5mol电子消耗2.5mol氯气。
2ClNO(g)反应的焓变,转移5mol电子消耗2.5mol氯气。
(3)①温度越高,反应速率越大,单位时间内消耗NO的量越多;
②根据![]() 计算5min内Cl2的反应速率;
计算5min内Cl2的反应速率;
③减小压强,平衡逆向移动;
④利用“三段式”计算Kp;
(4) ①根据图示,氢气、N2O在Ir表面生成氮气和水;
②Pt颗粒增多,更多的NO3-被还原为NH4+,不利于降低溶液中的含氮量。
(1)实验测得浓度相同的两溶液中,NaCN溶液的pH较大,则CN-水解程度比HCO3-大,则HCN的酸性弱于H2CO3。
(2)1mol Cl2参与反应发生焓变为243+2×630-2×(200+607)=-111kJ,此时转移2mol电子,则有5mol电子转移时,热量变化为277.5kJ。
(3)①温度越高,反应速率越大,单位时间内消耗NO的量越多,所以T1<T2。
②T1℃,5min内NO的物质的量0.5mol,Cl2的物质的量的变化为0.25mol,反应速率为![]() 0.05mol/(L·min)。
0.05mol/(L·min)。
③在相同容器中,充入1mol NO和0.5mol Cl2,容器中压强减小,反应向逆反应方向进行,NO转化率减小,小于50%。
④起始物质的量为3mol,压强为p0,反应后各物质变化为:
2NO + Cl2 = 2ClNO
起始物质的量 2 1 0
变化量 1 0.5 1
达平衡物质的量 1 0.5 1
同温同体积条件下,气体的压强之比等于其物质的量之比,则反应后压强为![]() ,则
,则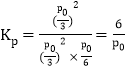 。
。
(4)①氢气、N2O在Ir表面生成氮气和水,Ir表面发生的反应为H2+N2O=H2O+N2;
②读图可知,若Pt颗粒增多,则NO3-更多转化为NH4+存在于溶液中,不利于降低溶液中的含氮量。


科目:高中化学 来源: 题型:
【题目】氯化钠是日常生活的必需品,也是重要的化工原料。粗盐除含NaCl外,还含有少量MgCl2、CaCl2、Na2SO4以及泥沙等杂质。以下是粗盐提纯的操作流程。

限选试剂:Na2CO3溶液、K2CO3溶液、NaOH溶液、BaCl2溶液、Ba(NO3)2溶液、饱和NaCl溶液。
(1)欲除去溶液I中的MgCl2、CaCl2、Na2SO4,从提供的试剂中选出a所代表的试剂,按滴加顺序依次为:过量的NaOH溶液、______、____。
(2)在滤液中加盐酸发生反应的化学方程式是_____;
(3)对溶液II处理得到晶体时,所必须使用到的玻璃仪器有_____种。
(4)得到的NaCl纯品经测定发现其含有的NaCl与粗盐中NaCl的质量一致,某同学认为此次实验非常成功没有误差,你是否同意他的观点?____(填“是”或“否”),并给出你的理由____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用11.9mol/L的浓盐酸配制80mL1.0mol/L稀盐酸,有如下操作步骤:
①用量筒量取_______mL浓盐酸倒入小烧杯中,加适量蒸馏水稀释;
②继续向容量瓶中加蒸馏水至液面距刻度线1~2 cm处,改用_______________小心滴加蒸馏水至溶液凹液面的最低处与刻度线相切;
③将容量瓶塞紧,充分摇匀;
④把①中所得溶液小心地转入___________________中;
⑤用少量蒸馏水洗涤烧杯和玻璃棒2~3次,洗涤液一并转移到容量瓶中。
(1)将上述操作步骤的空白处填写完整。
(2)本实验操作步骤的正确顺序是(填序号,不能重复)__________。
(3)使用玻璃棒在该实验中的两种作用分别是_____________________________________。
(4)配制过程中,下列情况会使配制结果偏高的是________(填序号)。
A. 洗净后容量瓶内还残留蒸馏水未烘干
B. 未洗涤烧杯和玻璃棒
C. 定容时,俯视刻度线
D. 定容后,加盖倒转摇匀后,发现液面低于刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NiCO3常用于催化剂、电镀、陶瓷等工业。现用某含镍电镀废渣(含Cu、Zn、Fe、Cr等杂质)制取NiCO3的过程如图所示:

(1)流程中的试剂X(某钠盐)的化学式是___________。
(2)“氧化”时需保持滤液在40℃左右,用6%的H2O2溶液氧化。控制温度不超过40℃的原因是______(用化学方程式表示)。
(3)Fe2+也可以用NaClO3氧化,生成的Fe3+在较小pH条件下水解,最终形成黄钠铁矾[Na2Fe6(SO4)4(OH)12]沉淀而被除去,如图是pH—温度关系图,图中阴影部分为黄钠铁矾稳定存在的区域,下列说法不正确的是________(填字母)。

a.黄钠铁矾[Na2Fe6(SO4)4(OH)12]中铁为+2价
b.pH过低或过高均不利于生成黄钠铁矾,其原因相同
c.氯酸钠在氧化Fe2+时,1 mol NaClO3得到的电子数为6NA
d.工业生产中温度常保持在85~95 ℃,加入Na2SO4后生成黄钠铁矾,此时溶液的pH约为1.2~1.8。
(4)加入Na2CO3溶液时,确认Ni2+已经完全沉淀的实验方法是_______________。
(5)某小组利用NiCO3制取镍氢电池的正极材料碱式氧化镍(NiOOH),过程如图:

①已知 25℃时,Ksp[Ni(OH)2]=2×10-15,当调节 pH≥9 时,溶液中残留的c(Ni2+)________mol/L。
②写出在空气中加热Ni(OH)2制取NiOOH的化学方程式________________。
③镍氢电池电解液为30%的KOH,负极为MH(即吸氢材料M吸附氢原子)。充电时也可实现Ni(OH)2转化为NiOOH。请写出放电时该电池的总反应式______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知拆开1mol氢气中的化学键需要消耗436kJ能量,拆开1mol氧气中的化学键需要消耗498kJ能量,根据图中的能量图,回答下列问题:

(1)分别写出①②的数值:
①____________; ② ____________ ;
(2)生成H2O(g)中的1mol H-O键放出____________kJ的能量;
(3)已知:H2O(l)= H2O(g) △H = +44 kJ·mol-1 ,试写出氢气在氧气中完全燃烧生成液态水的热化学方程式:_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在同一溶液中一定能大量共存的是( )
A. 含大量Ba2+的溶液中:Cl-、K+、SO![]() 、CO
、CO![]()
B. 含大量H+的溶液中:Mg2+、Na+、CO![]() 、SO
、SO![]()
C. 含大量OH-的溶液中:K+、NO、SO![]() 、Cu2+
、Cu2+
D. 含大量Na+的溶液中:H+、K+、SO![]() 、NO
、NO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解法处理CO2和SO2混合污染气的原理如下图所示,电解质为熔融碳酸盐和硫酸盐,通电一段时间后,Ni电极表面形成掺杂硫的碳积层。下列说法错误的是

A. Ni电极表面发生了还原反应
B. 阳极的电极反应为:2O2—-4e-=O2
C. 电解质中发生的离子反应有:2SO2 +4O2—=2SO42—
D. 该过程实现了电解质中碳酸盐和硫酸盐的自补充循环
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应3A(s)+3B(g)=2C(g)+D(g),经3 min,B的浓度减少0.9 mol·L-1。对此反应速率的表示正确的是( )
A.用A表示的反应速率是0.4 mol·L-1·min-1
B.分别用B、C、D表示的反应速率之比是3∶2∶1
C.在2 min末的反应速率,用B表示是0.3 mol·L-1·min-1
D.在2 min内的反应速率,用C表示是0.3 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一)某化学兴趣小组设计了图示实验装置(图中省略了夹持仪器)来测定某铁碳合金中铁的质量分数。
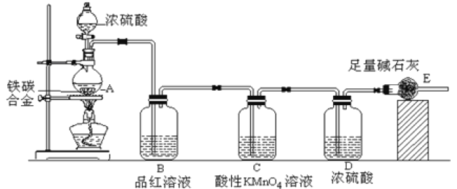
(1)仪器A的名称是___________。
(2)C装置的作用______________。
(3)该小组同学设计的实验装置存在缺陷,有关该实验装置及实验过程中,下列因素可能会导致铁质量分数测量值偏低的是___________。
A.A中反应不完全
B.反应生成的SO2部分被E中碱石灰吸收
C.E中碱石灰会吸收空气中的CO2和H2O
D.反应完全后,还有CO2气体滞留在装置体系中
(二)将19.20 g CuO和Fe2O3的混合物在高温下与足量的CO充分反应,反应后全部气体用200 mL 1.20 molL-1 Ba(OH)2溶液吸收,生成35.46 g白色沉淀(不考虑沉淀的溶解,忽略溶液体积的变化)。
(4)则吸收气体后溶液中溶质的化学式为________,其浓度为_________。
(5)混合物中CuO和Fe2O3的物质的量之比为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com