
X、Y、Z、W均为短周期元素,它们在元素周期表中的相对位置如图所示。若Z原子的最外层电子数是第一层电子数的3倍,下列说法中正确的是 ( )。
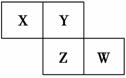
A.X的最常见气态氢化物的水溶液显酸性
B .最高价氧化物对应水化物的酸性W比Z强
.最高价氧化物对应水化物的酸性W比Z强
C.Z的单质与氢气反应比Y单质与氢气反应剧烈
D.X的原子半径小于Y
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案科目:高中化学 来源: 题型:
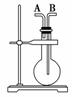 今有下列气体:H2、Cl2、CH4、HCl、NH3、NO、H2S、SO2,用 如 图装置进行实验,填写下列空白:
今有下列气体:H2、Cl2、CH4、HCl、NH3、NO、H2S、SO2,用 如 图装置进行实验,填写下列空白:
(1)当烧瓶干燥时,从A口进气可收集的气体是 ________________,从B口进气可收集的气体是________。
(2)当烧瓶中充满水时,可用来测量________等气体的体积。
(3)当烧瓶中装入某种溶液,用于洗气时,气体应从____ ____口进入烧瓶。
____口进入烧瓶。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A.1molO的质量是32g B.HCl相对分子质量36.5g/mol
C.SO42-的摩尔质量是96g/mol D.Na的相对原子质量23g/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
在强酸性无色透明的溶液中能大量共存的离子组是
A.K+、Na+、NO3-、Fe3+ B. Na十、HCO3-、OH-、SO42-
C.K+、Na十、Br-、Cu2+ D. Mg2+、Na+、Cl-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)相同物质的量的CO2与SO3,其质量之比为 ,原子数目之比为 。
(2)某气态氧化物化学式为RO2,在标准状下,1.28g该氧化物的体积为448mL,则该氧化物的摩尔质量为 ,R的相对原子质量为____________。
(3)10%的硫酸溶液,密度为1.07g/cm3,其物质的量浓度为 。
(保留三位有效数字)
(4)200 mL、2.0 mol/L的Al2(SO4)3溶液中含Al3+的物质的量为 。从中取出10mL,Al2(SO4)3物质的量浓度为 ,若将这10mL溶液用水稀释到50mL,所得溶液中溶质的物质的量浓度为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
位于短周期的四种元素A、B、C、D,其原子序数依次增大。A在周期表中原子半径最小;B是地壳中含量最高的元素;B、D位于 同一主族;C的原子半径在同周期中最大。
同一主族;C的原子半径在同周期中最大。
回答下列问题:
(1)写出由上述元素形成的具有漂白作用的3种物质的化学式:________、________、________。
(2)写出含B元素质量分数最高的化合物的电子式:_________________________
____________________________ ____________________________________________。
____________________________________________。
(3)分别由A、B、C、D四种元素组成的两种化合物X和Y可以发生反应,试写出该反应的离子方程式:
_______________________________________________________。
(4)用电子式表示化合物C2B的形成过程:
__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列每组中各物质内既有离子键又有共价键的一组是 ( )。
A.NaOH、H2SO4、(NH4)2SO4
B.MgO、Na2SO4、NH4HCO3
C.Na2O2、KOH、Na2SO4
D.HCl、Al2O3、MgCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
元素X、Y、Z、M、N均为短周期主族元素,且原子序数依次增大。已知Y元素原子最外层电子数与核外电子总数之比为3∶4,M元素原子的最外层电子数与次外层电子数之比为3∶4,且M原子的质子数是Y原子的2倍;N-、Z+、X+的半 径逐渐减小;化合物XN在常温下为气体,据此回答下列问题:
径逐渐减小;化合物XN在常温下为气体,据此回答下列问题:
(1)写出Z与N形成的化合物的化学式________________________________。
(2)X与Y可分别形成10电子和18电子的分子,写出该18电子分子转化成10电子分子的化学方程式________________(分解反应)。
(3)下图表示由上述元素组成的两种气体分子在一定条件下的密闭容器中充分反应前后的转化关系,请写出该转化过程的化学方程式:______________
_________________________________________________________________。
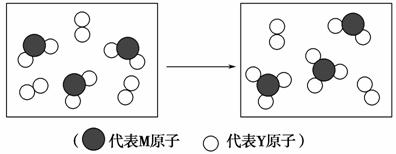
(4)A、B均为由上述五种元素中的三种元素组成的强电解质,且组成元素的原子个数之比为1∶1∶1。若在各自的水溶液中,A能抑制水的电离,B能促进水的电离,则A的化学式为______________,B的化学式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
美国宇航局“凤凰”号火星登陆器的显微、电子化学及传导分析仪对两份土壤样本的分析发现,火星北极区表层土壤可能含有高氯酸盐,可创造不利于任何 潜在生命的恶劣环境。则下列说法错误的是 ( )。
潜在生命的恶劣环境。则下列说法错误的是 ( )。
A.含有高氯酸盐的土壤不利于生命存在与高氯酸盐具有较强的氧化性有关
B.当元素处于最高价态时一定具有强氧化性
C.可以考虑用加入亚铁盐等还原性物质的方法改善这种土壤
D.一定条件下高氯酸盐能与浓盐酸反应生成氯气
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com