
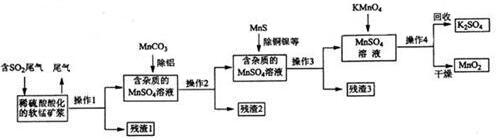
分析 由流程可知,二氧化硫能与二氧化锰反应生成硫酸锰,用MnCO3能除去溶液中Al3+,MnS与铜、镍离子混合转化为CuS、NiS沉淀,过滤,滤液中含有硫酸锰,高锰酸钾能与硫酸锰反应生成二氧化锰,通过过滤获得二氧化锰;
(1)a.食品在加工过程中,可能含有极少量的SO2;
b.SO2具有还原性,能与强氧化剂反应;
c.亚硫酸不是强酸;
d.SO2与CaCl2溶液不反应;
(2)操作1是分离固液混合物;
(3)MnCO3消耗氢离子,促进铝离子的水解;
(4)根据沉淀的转化分析;
(5)碱性锌锰电池中Zn与MnO2反应生成MnOOH和氢氧化锌;
(6)酸性条件下KMnO4与MnSO4溶液反应生成二氧化锰;
(7)SO2与软锰矿浆中的MnO2反应生成硫酸锰;根据方程式中二氧化硫与二氧化锰之间的关系计算.
解答 解:由流程可知,二氧化硫能与二氧化锰反应生成硫酸锰,用MnCO3能除去溶液中Al3+,MnS与铜、镍离子混合转化为CuS、NiS沉淀,过滤,滤液中含有硫酸锰,高锰酸钾能与硫酸锰反应生成二氧化锰,通过过滤获得二氧化锰;
(1)a.食品在加工过程中,可能含有极少量的SO2,所以食品中允许含有极少量的SO2,故a错误;
b.SO2具有还原性,能与强氧化剂反应,所以SO2能使酸性KMnO4溶液褪色,故b正确;
c.SO2溶于水生成亚硫酸,亚硫酸不是强酸,故c错误;
d.SO2与CaCl2溶液不反应,所以SO2通过CaCl2浓溶液能生成沉淀,故d错误;
故答案为:b;
(2)操作1是分离固液混合物,所以其操作名称为过滤;故答案为:过滤;
(3)向溶液中加MnCO3会消耗氢离子,促进Al3+的水解生成氢氧化铝沉淀,从而除去溶液中的铝离子;
故答案为:MnCO3消耗氢离子,促进Al3+水解生成氢氧化铝沉淀;
(4)CuS和NiS的溶解度小于MnS的溶解度,当溶液中加MnS时会发生沉淀的转化,即生成CuS、NiS沉淀,从而除去铜离子和镍离子;
故答案为:CuS和NiS的溶解度小于MnS的溶解度,发生沉淀的转化;
(5)碱性锌锰电池中Zn与MnO2反应生成MnOOH和氢氧化锌,则碱性锌锰电池的总反应:Zn+2MnO2+2H2O═2MnOOH+Zn(OH)2;
故答案为:Zn+2MnO2+2H2O═2MnOOH+Zn(OH)2;
(6)酸性条件下KMnO4与MnSO4溶液反应生成二氧化锰,其反应的离子方程式为:2MnO4-+3Mn2++2H2O=5MnO2↓+4H+;
故答案为:2MnO4-+3Mn2++2H2O=5MnO2↓+4H+;
(7)SO2与软锰矿浆中的MnO2反应生成硫酸锰,其反应方程式为:SO2+MnO2=MnSO4;2240 m3(标准状况)含有0.86%(体积分数)SO2,二氧化硫的物质的量为$\frac{2240×1{0}^{3}L}{22.4L/mol}$×0.86%=860mol,
3SO2~3MnSO4~2MnO4-~5MnO2,
3 5
860mol n
则m(MnO2)=$\frac{860mol×5}{3}$×87g/mol=124700g=124.7kg;
故答案为:SO2+MnO2=MnSO4;124.7.
点评 本题以物质的制备实验考查混合物分离提纯的综合应用,把握流程分析及混合物分离方法、发生的反应为解答的关键,侧重分析与实验、计算能力的考查,综合性较强,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向反应后的溶液加入乙醇,溶液没有发生变化 | |
| B. | 沉淀溶解后,将生成深蓝色的配合离子[Cu(NH3)4]2+ | |
| C. | 在[Cu(NH3)4]2+离子中,Cu2+给出孤对电子,NH3提供空轨道 | |
| D. | 反应后溶液中不存在任何沉淀,所以反应前后Cu2+的浓度不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu与过量浓HNO3反应,生成的气体呈红棕色 | |
| B. | 足量H2通过灼热的CuO粉末后,生成的固体为红色 | |
| C. | AgNO3溶液与足量Na2S溶液反应后再滴加NaCl溶液,沉淀为白色 | |
| D. | 物质的量相同的CH3COOH与NaOH反应后滴加酚酞,溶液显红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验目的 | 实验方案 |
| A | 氯气的氧化性 | 将湿润的淀粉KI试纸放于充满 Cl2的集气瓶口,试纸变蓝 |
| B | 配制 480mL 0.2mol/L NaOH溶液 | 准确称量NaOH固体4.0g溶于水,配制成 500mL溶液 |
| C | 比较 H2CO3 和 H2SO4的酸性强弱 | 室温下,用PH试纸测定浓度为O.lmol•L-1Na2CO3溶液和 0.lmol•L-1NazSO4溶液的 pH |
| D | 证明氧化性: H2O2>Fe3+ | 用硫酸酸化的H2O2滴入Fe(NO3)2洛液中,浓液变黄色 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使湿润的蓝色石蕊试纸变红的气体是氨气 | |
| B. | 瓷坩埚可用作Na2CO3与石英制Na2SiO3的反应容器 | |
| C. | 热Na2CO3溶液更利于清洗餐具上的油污 | |
| D. | 某溶液中加入BaCl2溶液,产生不溶于稀硝酸的沉淀,该溶液一定含有SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
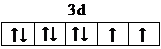 ,很多不饱和有机物在E催化下可与H2发生加成反应:如①CH2=CH2、②HC≡CH、③
,很多不饱和有机物在E催化下可与H2发生加成反应:如①CH2=CH2、②HC≡CH、③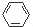 、④HCHO.其中碳原子采取sp2杂化的分子有①③④(填物质序号),HCHO分子的立体结构为平面三角形,它加成产物的熔、沸点比CH4的熔、沸点高,其主要原因是(须指明加成产物是何物质)加成产物CH3OH分子之间能形成氢键.
、④HCHO.其中碳原子采取sp2杂化的分子有①③④(填物质序号),HCHO分子的立体结构为平面三角形,它加成产物的熔、沸点比CH4的熔、沸点高,其主要原因是(须指明加成产物是何物质)加成产物CH3OH分子之间能形成氢键.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com