
| A. | 弱酸性溶液中:Na+、NH4+、NO3-、Cl- | |
| B. | 无色溶液中:Fe3+、NH4+、Cl-、HS- | |
| C. | 水电离出的C(H+)=1×10-13mol•L-1的溶液中:Ca2+、HCO3-、I-、NO3- | |
| D. | 漂白粉的水溶液中:Fe2+、SO42-、Mg2+、Na+ |
分析 A.酸性条件下离子之间不发生反应;
B.有颜色的离子不能大量共存;
C.水电离出的C(H+)=1×10-13mol•L-1的溶液可能呈酸性或碱性;
D.漂白粉的水溶液呈碱性、氧化性.
解答 解:A.酸性条件下离子之间不发生反应,可大量共存,故A正确;
B.Fe3+有颜色,不能大量共存,故B错误;
C.水电离出的C(H+)=1×10-13mol•L-1的溶液可能呈酸性或碱性,无论酸性或碱性HCO3-都不能大量共存,故C错误;
D.漂白粉的水溶液呈碱性、氧化性,Fe2+、Mg2+不能大量存在,故D错误.
故选A.
点评 本题考查离子共存,侧重考查复分解反应、氧化还原反应,为高考高频点,明确离子共存条件及离子性质即可解答,难度不大.


 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用活性炭做净化剂去除冰箱中异味 | |
| B. | Fe2O3俗称铁红,常用作红色油漆和涂料 | |
| C. | 推广应用燃料“脱硫、脱硝”技术,可减少硫氧化物和氮氧化物对空气的污染 | |
| D. | 在食品袋中放入盛有CaCl2•6H2O和铁粉的透气小袋,可防止食物受潮、氧化变质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
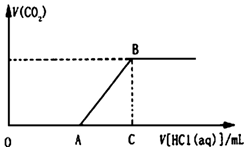 向100mL某物质的量浓度的NaOH溶液中缓慢通入一定量的CO2,使其充分反应.在上述所得溶液中,逐滴缓慢滴加1mol•L-1的盐酸,所得气体(不考虑溶解)的体积与滴加盐酸的体积关系如图(其中点A是线段OC上的动点):
向100mL某物质的量浓度的NaOH溶液中缓慢通入一定量的CO2,使其充分反应.在上述所得溶液中,逐滴缓慢滴加1mol•L-1的盐酸,所得气体(不考虑溶解)的体积与滴加盐酸的体积关系如图(其中点A是线段OC上的动点):查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向豆浆中加入硫酸钙做豆腐 | |
| B. | 将植物油倒入水中用力搅拌形成油水混合物 | |
| C. | 利用丁达尔效应可以区别溶液与胶体 | |
| D. | 观看电影时,从放映机到银幕有明显的光路 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化还原反应中氧化剂和还原剂一定是两种物质 | |
| B. | 氧化还原反应中氧化产物和还原产物一定是两种物质 | |
| C. | 作氧化剂的物质一定不能作还原剂 | |
| D. | 所含元素处于中间价态时的物质,既可作氧化剂也可作还原剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com