
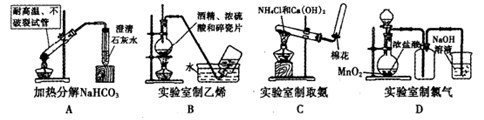
 天天向上口算本系列答案
天天向上口算本系列答案科目:高中化学 来源:不详 题型:实验题


查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
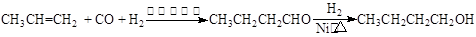
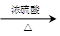 CO↑+H2O,并设计出原料气的制备装置(如下图)
CO↑+H2O,并设计出原料气的制备装置(如下图)
 RCH(OH)SO3Na↓;②沸点:乙醚34℃,
RCH(OH)SO3Na↓;②沸点:乙醚34℃,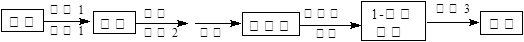
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
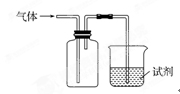
| 选项 | 气体 | 试剂 | 现象 | 结论 |
| A. | NO | 紫色石蕊试液 | 溶液变红 | NO与水反应生成硝酸 |
| B. | C2H4 | 溴水 | 溶液褪色 | 乙烯能与溴发生加成反应 |
| C. | SO2 | 酸性KMnO4溶液 | 溶液褪色 | SO2有还原性 |
| D. | NH3 | MgCl2溶液 | 产生白色沉淀 | NH3有碱性 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
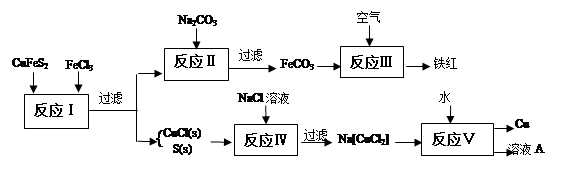
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
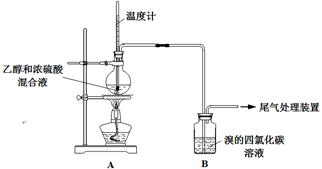
| 操 作 | 现 象 |
| 点燃酒精灯, 加热至170℃ | Ⅰ:A中烧瓶内液体渐渐变黑 Ⅱ:B内气泡连续冒出,溶液逐渐褪色 |
| …… | |
| 实验完毕, 清洗烧瓶 | Ⅲ:A中烧瓶内附着少量黑色颗粒状物,有刺激性气味逸出 |
| | 设 计 | 现 象 |
| 甲 | 在A、B间增加一个装有某种试剂的洗气瓶 | Br2的CCl4溶液褪色 |
| 乙 | 与A连接的装置如下: | D中溶液由红棕色变为浅红棕色时,E中溶液褪色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com