
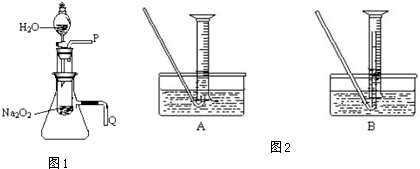
分析 (1)脱脂棉燃烧除了有氧气外,必须要达到其燃点,据此可判断该反应是放热反应;
(2)该小题实质上是考查氧气的检验、气密性检查等化学实验基本操作方法的运用,将带火星的木条靠进导管口P处,木条复燃,将导管Q浸入水中,反应过程中导管口有气泡冒出;
(3)H2O2在MnO2催化条件下会生成氧气;
(4)测量气体体积时,为防止倒吸应将导管尽量插入量筒底部,使用的量筒应是生成氧气的最大值.
解答 解:(1)脱脂棉燃烧除了有氧气外,必须要达到其燃点,则该反应为放热反应,反应的化学方程式为2Na2O2+2H2O=4NaOH+O2↑,
故答案为:该反应是放热反应; 2Na2O2+2H2O=4NaOH+O2↑;
(2)检验是否有氧气生成,可根据氧气能使带火星的木条复燃进行检验,具体做法是打开分液漏斗活塞使水流入试管,再将带火星的木条靠近导管口P处,木条复燃,证明有O2生成;该反应为放热反应,容器温度升高,容器内气体会膨胀,因此,将导管Q浸入水中,反应过程中导管口有气泡冒出;
故答案为:打开分液漏斗活塞使水流入试管,再将带火星的木条靠近导管口P处,木条复燃,证明有O2生成;将导管Q浸入水中,反应过程中导管口有气泡冒出;
(3)H2O2在MnO2催化条件下会生成氧气,加入催化剂,过氧化氢分解生成氧气,溶液中有气泡产生,且能使带火星的木条复燃,证明有氧气生成,故答案为:MnO2; 气泡迅速产生,能使带火星的木条复燃;
(4)①测量气体体积时,为防止倒吸应将导管尽量插入量筒底部,所以应用B装置,
故答案为:B;防止气体冷却时发生倒吸现象;
②n(Na2O2)=$\frac{2.6g}{78g/mol}$=$\frac{1}{30}$mol,
2Na2O2+2H2O=4NaOH+O2↑
2mol 22.4L
$\frac{1}{30}$mol V(O2)
V(O2)=$\frac{\frac{1}{30}×22.4}{2}$L=0.373L=373mL,
所以应用500mL的量筒,
故答案为:500mL.
点评 本题重视从高中化学课本实验中选取命题素材,重视在课本实验的基础上考查探究能力是化学学科最有吸引力的话题之一.实验题,倾向于考查化学实验基本操作,倾向于把一些课本小实验重组成一个微型的研究课题,所以要提高解答化学实验题的得分率必须从课本中的基本实验入手.


 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案科目:高中化学 来源: 题型:实验题
 如图为氢气还原氧化铜的微型快速实验装置.实验前先将铜丝1处理成下端弯曲的小圆环,并用铁锤击成带小孔的小匙,将铜丝2一端弯曲成螺旋状.试回答下列问题:
如图为氢气还原氧化铜的微型快速实验装置.实验前先将铜丝1处理成下端弯曲的小圆环,并用铁锤击成带小孔的小匙,将铜丝2一端弯曲成螺旋状.试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 若pH=7,HA的浓度一定为0.1 mol•L-1 | |
| B. | 若pH>7,HA的pH不可能等于1 | |
| C. | 若pH<7,溶液中的微粒浓度关系为:c(Na+)=c(HA)+c(A-) | |
| D. | 若pH=12,且HA为强酸时,HA的浓度应为0.08 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(A)=0.15mol/(L•min) | B. | v(B)=0.04mol/(L•s) | ||
| C. | v(C)=0.03mol/(L•s) | D. | v(D)=0.4mol/(L•min) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 定醛 | B. | 丙醛 | C. | 乙醛 | D. | 甲醛 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化钠可用作调味剂 | |
| B. | Na2O常用于潜水艇或呼吸面具的供氧剂 | |
| C. | 明矾可用作净水剂 | |
| D. | 常温下,可用铝制容器储运浓硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 混合气体的压强 | B. | 混合气体的密度 | ||
| C. | C的物质的量浓度 | D. | 气体的总物质的量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com