
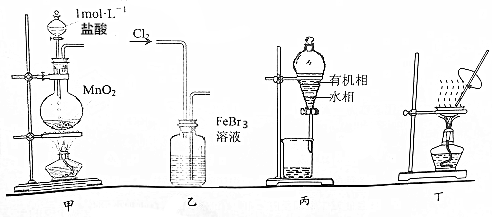
| A. | 用装置甲制取氯气 | |
| B. | 用装置乙氧化FeBr3溶液中的溴离子 | |
| C. | 用装置丙分液时先从下口放出水相,再从上口倒出有机相 | |
| D. | 用装置丁将分液后的水相蒸发至干,再灼烧制得无水FeCl3 |
分析 A.实验室用浓盐酸和二氧化锰加热制取氯气,稀盐酸和二氧化锰不反应;
B.用氯气氧化溴离子时,导气管应该采用“长进短出”原则;
C.分液时,上层液体从上口倒出,下层液体从下口倒出;
D.加热氯化铁溶液时氯化铁水解生成氢氧化铁和HCl,升高温度促进水解.
解答 解:A.实验室用浓盐酸和二氧化锰加热制取氯气,稀盐酸和二氧化锰不反应,因为该实验中用的是稀盐酸,所以不能用该装置制取氯气,不能实现实验目的,故A错误;
B.用氯气氧化溴离子时,导气管应该采用“长进短出”原则,所以该装置错误,不能实现实验目的,故B错误;
C.分液时,上层液体从上口倒出,下层液体从下口倒出,所以用装置丙分液时先从下口放出水相,再从上口倒出有机相,否则易引进杂质,所以能实现实验目的,故C正确;
D.加热氯化铁溶液时氯化铁水解生成氢氧化铁和HCl,升高温度促进水解,为防止水解,应该在HCl氛围中加热蒸干氯化铁溶液,则不能实现实验目的,故D错误;
故选C.
点评 本题考查化学实验方案评价,为高频考点,涉及物质制备、实验操作等知识点,明确实验原理、物质性质、实验操作规范性是解本题关键,侧重考查学生实验操作能力、实验分析评价能力,题目难度不大.


 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案科目:高中化学 来源: 题型:解答题
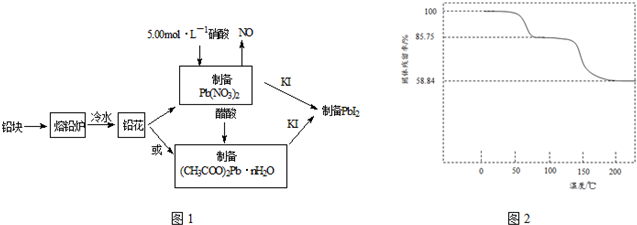
| 实验内容 | 实验方法 | 实验现象及原因分析 |
| ①磺离子浓度增大对平衡的影响 | 取PbI2饱和溶液少量于一支试管中,再滴入几滴NaI饱和溶液 | 现象:溶液中c(I-)增大,使Q大于了PbI2的Ksp |
| ②铅离子浓度减小对平衡的影响 | 取PbI2悬浊液少量于一支试管中,再加入少量NaCl饱和溶液 | 现象:黄色浑浊消失 原因:形成PbCl42-,导致溶液中c(Pb2+)减小,使Qc小于PbI2的Ksp |
| ③铅离子和碘离子浓度都减小对平衡的影响 | 在PbI2悬浊液中滴入几滴FeCl3 饱和溶液 | 现象:黄色浑浊消失 写出反应的离子方程式: PbI2+2Fe3++4Cl-=PbCl42-+2Fe2++I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
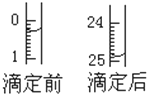 某学生用0.1mol•L-1的KOH标准溶液滴定未知浓度的盐酸,其操作分解为如下几步:
某学生用0.1mol•L-1的KOH标准溶液滴定未知浓度的盐酸,其操作分解为如下几步:| 滴定序号 | 待测液体积(mL) | 所消耗KOH标准液的体积(mL) | ||
| 滴定前 | 滴定后 | 消耗的体积 | ||
| 1 | 20.00 | 0.50 | 25.12 | 24.62 |
| 2 | 20.00 | 0.30 | 24.90 | 24.60 |
| 3 | 20.00 | 6.00 | 30.58 | 24.58 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
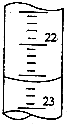 用中和滴定法测定烧碱的纯度,若烧碱中不含有与酸反应的杂质,试根据实验回答:
用中和滴定法测定烧碱的纯度,若烧碱中不含有与酸反应的杂质,试根据实验回答:| 滴定次数 | 待测液体积/mL | 标准盐酸体积/mL | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 10.00 | 0.50 | 20.40 |
| 第二次 | 10.00 | 4.00 | 24.10 |
| 第三次 | 10.00 | 4.20 | 25.70 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 容器编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
| CH3OH(g) | CH3OCH3(g) | H2O(g) | ||
| Ⅰ | 390 | 0.20 | 0.080 | 0.080 |
| Ⅱ | 390 | |||
| Ⅲ | 230 | 0.20 | 0.090 | 0.090 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 58.5 g氯化钠固体中含有NA个氯化钠分子. | |
| B. | 1 mol Fe参与反应失去电子数目一定为2NA | |
| C. | 1 molNA被完全氧化生成Na2O2,失去2NA个电子 | |
| D. | 常温下,46 g NO2和N2O4的混合物中含有的氮原子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在标准状况下,22.4L水的质量约为18g | |
| B. | 22.4LN2含6.02×1023个氮气分子 | |
| C. | 2gH2占有的体积约为22.4L | |
| D. | 22g二氧化碳与标准状况下11.2LHCl气体含有相同的分子数 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com