
| A. | 甲烷 | B. | 乙烯 | C. | 乙炔 | D. | 乙醇 |
分析 二氧化碳被认为是加剧温室效应的主要来源,相同质量的有机物含碳量越低,完全燃烧生成二氧化碳的量越少,产生的温室效应越小,据此解答.
解答 解:二氧化碳被认为是加剧温室效应的主要来源,相同质量的有机物含碳量越低,完全燃烧生成二氧化碳的量越少,产生的温室效应越小,
甲烷中碳的百分含量为$\frac{12}{16}$×100%=75%;
乙烯中碳的百分含量为$\frac{24}{27}$×100%=85.7%;
乙炔中碳的百分含量为$\frac{24}{26}$×100%=92.3%;
乙醇中碳的百分含量为$\frac{24}{46}$×100%=52.2%;
所以质量相同的下列物质完全燃烧时所产生的温室效应最小的是乙醇,
故选:D.
点评 本题考查了温室效应的产生,明确物质含碳量高低是解题关键,题目难度不大.


科目:高中化学 来源: 题型:解答题

| 周期 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| 元素种类 | 2 | 8 | 8 | 18 | 18 | 32 | 32 |
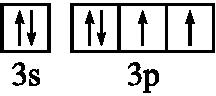 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | BaCl2 Na2CO3 AgNO3 盐酸 | B. | BaCl2 Na2CO3 盐酸 AgNO3 | ||
| C. | Na2CO3 盐酸 AgNO3 BaCl2 | D. | AgNO3 盐酸 BaCl2 Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | n(Cl2):n(Fe)=5:4 5Cl2+4Fe$\frac{\underline{\;点燃\;}}{\;}$2FeCl2+2FeCl3 | |
| B. | n(Cl2):n(FeBr2)=1:1 Fe2++2Br-+Cl2═Fe3++Br2+2Cl- | |
| C. | n(MnO4-):n(H2O2)=2:3 2MnO4-+3H2O2+6H+═2Mn2++4O2↑+6H2O | |
| D. | n(Fe):n(HNO3(稀))═1:3 4Fe+12H++3NO3-=3Fe2++Fe3++3NO↑+6H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ⑩ | ① | ② | ③ | ||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
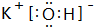 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ①④ | C. | ①③ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将两种带相反电荷的胶体混合,能发生聚沉 | |
| B. | 有化学键断裂的变化一定是化学变化 | |
| C. | IA族元素形成的单质的熔点随原子序数的递增而降低 | |
| D. | 碱性氧化物一定是金属氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com