
分析 (1)浓度、压强增大、升高温度、加入催化剂等都会加快反应速率,化学平衡状态下,改变其中一个条件平衡就会向减弱这种改变的方向移动,注意固体和纯液体不影响化学反应速率和化学平衡;
(2)C表示的反应速率为0.2mol/(L•min),平衡时C的浓度为0.4mol/L,则n(C)=0.4mol/L×2L=0.8mol,结合n(D)利用物质的量之比等于化学计量数之比计算x;
(2)根据平衡时n(D),由方程式可知参加反应的n(B)=$\frac{1}{2}$n(D),再根据转化率定义计算B的转化率,如果其他条件不变,将容器的容积变为1L,体积减小物质浓度增大,反应速率增大,反应前后气体体积不变,增大压强反应速率增大,平衡不变,由反应可知反应前后气体的物质的量不变,恒温恒容下,按化学计量数转化到左边,满足n(A):n(B)=2mol:2mol=1:1即可,据此判断应加入的物质及该物质的量物质的量;
解答 (1)因铁是固体,增加铁的量,没有增加铁的浓度,所以不能改变反应速率,
容器的体积缩小,容器内各物质的浓度都增大,浓度越大,化学反应速率越快,
体积不变,充入N2使体系压强增大,但各物质的浓度不变,所以反应速率不变,
压强不变,充入N2使容器的体积增大,但各物质的浓度都减小,浓度越小,反应速率越小,
故答案为:不变;增大,增大;不变,不变;减小,减小.
(2)以C表示的反应速率为0.2mol/(L•min),平衡时C的浓度为0.4mol/L,则n(C)=0.4mol/L×2L=0.8mol,物质的量之比等于化学计量数之比,所以0.8mol:0.8mol=x:2,解得x=2,平衡时n(D)=0.8mol,由方程式可知参加反应的n(B)=$\frac{1}{2}$n(D)=$\frac{1}{2}$×0.8mol=0.4mol,故B的转化率为$\frac{0.4mol}{2mol}$×100%=20%,
如果其他条件不变,将容器的容积变为1L,浓度增大,则容器中压强增大进行同样的实验,则与上述反应比较:反应速率将增大,反应前后气体体积不变,增大压强平衡不变,平衡时反应物的转化率不变,该反应前后气体的物质的量不变,恒温恒容下,按化学计量数转化到左边,满足n(A):n(B)=2mol:2mol=1:1即可,开始加入C和D各$\frac{4}{3}$mol,由化学方程式3A(g)+B(g)?2C(g)+2D(g)可知转化到左边,可以得到A为$\frac{4}{2}$mol×$\frac{3}{2}$=2mol,得到B为$\frac{4}{3}$mol×$\frac{1}{2}$=$\frac{2}{3}$mol,故还需要加入B,加入B的物质的量为2mol-$\frac{2}{3}$mol=$\frac{4}{3}$mol;
故答案为:?2,20%;增大 体积减小,反应物的浓度增大,因为使反应速率增大,不变,反应前后气体的总体积无变化,平衡不发生移动,$\frac{4}{3}$;
点评 本题考查化学平衡的有关计算、影响化学平衡的因素、等效平衡等,难度中等,注意等效平衡规律的掌握,掌握基础是关键.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2016-2017学年江西省高二上第一次月考化学卷(解析版) 题型:选择题
能降低反应所需的活化能的是( )
A.降低温度 B.使用催化剂 C.增大压强 D.增加浓度
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省高二上10月阶段测化学卷(解析版) 题型:选择题
下列变化过程不能直接实现的是
①HCl ②Cl2 ③Ca(ClO)2 ④HClO ⑤CO2
A.①→② B.②→③ C.③→④ D.④→⑤
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 曲线a和b表示两个反应过程的反应热不同 | |
| B. | 曲线a一定表示反应是在无催化剂时的反应过程 | |
| C. | 增大压强,X的转化率一定增大 | |
| D. | 反应达平衡,升高温度,平衡常数K值一定减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无色液体 | B. | 可以被氧化 | ||
| C. | 能与水以任意比例混溶 | D. | 能与氢氧化钠溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,1mol铜片投入含有4mol HNO3的浓硝酸中,铜片可以完全溶解 | |
| B. | Al与S直接化合可以得到Al2S3,Fe与S直接化合也可以得到Fe2S3 | |
| C. | 电解AlCl3、FeCl3、CuCl2的混合溶液中,阴极上依次析出Cu、Fe、Al | |
| D. | 等质量的钠铝合金中铝的含量越大,与足量盐酸反应时放出的氢气越少 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | Mn | Fe | |
| 电离能 | I1 | 717 | 759 |
| (kJ•mol-1) | I2 | 1 509 | 1 561 |
| I3 | 3 248 | 2 957 | |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
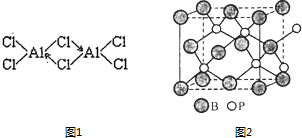 硼(B)、铝(Al)、镓(Ga)均属于硼族元素(第ⅢA族),它们的化合物或单质都有重要用途.回答下列问题:
硼(B)、铝(Al)、镓(Ga)均属于硼族元素(第ⅢA族),它们的化合物或单质都有重要用途.回答下列问题: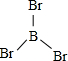 三溴化磷
三溴化磷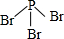
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com