【化学—选修2:化学与技术】(15分)
化学是人类进步的关键,化学为人类的生产、生活提供了物质保证。
Ⅰ.氮的化合物是重要的化工产品。其生产方法也在逐渐改进中,各国科学家均在为提高其产量,降低能耗做各种有益的探究。
(1)25℃时合成氨反应热化学方程式为:N2(g)+3H2(g)==2NH3(g),ΔH="-92.4kJ/mol" 。在该温度时,取1molN2和3molH2放在密闭容器中,在催化剂存在下进行反应,测得反应放出的热量总是小于92.4kJ。其原因是_________________________________。
(2)近年有人将电磁场直接加在氮气与氢气反应的容器内,在较低的温度和压强条件下合成氨,获得了较好的产率。从化学反应本质角度分析,电磁场对合成氨反应的作用是 ;与传统的合成氨的方法比较,该方法的优点是 。
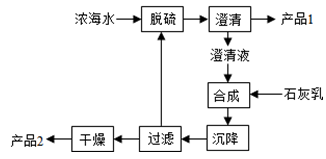
Ⅱ.(3)卤水中蕴含着丰富的镁资源,经转化后可获得MgCl2粗产品。从卤水中提取镁的步骤为:
a.将海边大量存在的贝壳煅烧成石灰,并将石灰制成石灰乳;
b.将石灰乳加入到海水沉淀池中经过滤得到Mg(OH)2沉淀;
c.在Mg(OH)2沉淀中加入盐酸得到MgCl2溶液,再经蒸发结晶得到MgCl2·6H2O;
d.将MgCl2·6H2O在一定条件下加热得到无水MgCl2;
e.电解熔融的氯化镁可得到Mg。
①步骤d中的“一定条件”指的是 。
②有同学认为:步骤b后可加热Mg(OH)2得到MgO,再电解熔融的MgO制金属镁,这样可简化实验步骤,你同意该同学的想法吗?为什么?
(4) 铀是核反应最重要的燃料,已经研制成功一种螫合型离子交换树脂,它专门吸附海水中 的U4+,而不吸附其他元素。其反应原理为 (树脂用HR代替),发生离子交换后的离子交换膜用酸处理还可再生并得到含铀的溶液,其反应原理为: 。



 NaBr + NaBrO3+6NaHCO3,吸收1mol Br2时转移的电子为 mol。
NaBr + NaBrO3+6NaHCO3,吸收1mol Br2时转移的电子为 mol。