
二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂。
(1)工业上制备ClO2的反应原理常采用:2NaClO3+4HCl=2ClO2↑+Cl2↑+2H2O+2NaCl。
① 浓盐酸在反应中显示出来的性质是_______(填序号)。
A.只有还原性 B.还原性和酸性 C.只有氧化性 D.氧化性和酸性
② 若上述反应中产生0.1 mol ClO2,则转移电子的物质的量为_______mol。
(2)目前已开发出用电解法制取ClO2的新工艺。
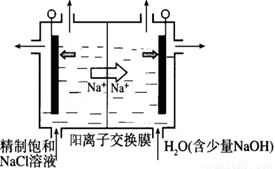
①上图示意用石墨做电极,在一定条件下电解饱和食盐水制取ClO2。写出阳极产生ClO2的电极反应式:__________。
②电解一段时间,当阴极产生的气体体积为112 mL(标准状况)时,停止电解。通过阳离子交换膜的阳离子的物质的量为_________mol;用平衡移动原理解释阴极区pH增大的原因______________。
(3)ClO2对污水中Fe2+、Mn2+、S2—和CN-等有明显的去除效果。某工厂污水中含CN- a mg/L,现用ClO2将CN-氧化,只生成两种气体,其离子反应方程式为_______;处理100 m3这种污水,至少需要ClO2 _______ mol 。
(共12分)
(1)①B ② 0.1 (各1分)
(2)①Cl- - 5e- + 2H2O = ClO2↑+ 4H+
②0.01
在阴极发生2H+ + 2e- =H2↑,H+浓度减小,使得H2O OH- +H+的平衡向右移动,OH-浓度增大,pH增大
OH- +H+的平衡向右移动,OH-浓度增大,pH增大
(3)2ClO2+2CN- = N2↑+ 2CO2↑+2Cl- 50a/13(或3.85a)
【解析】
试题分析:
(1)①盐酸中部分Cl价态升高变为氯气,部分生成盐,体现还原性和酸性②式中转移电子数为2,反应中产生0.1 mol ClO2,则转移电子的物质的量为0.1mol
(2)①可得Cl- -
5e- + 2H2O = ClO2↑+ 4H+。②阴极产生标准状况的气体体积为112
mL(0.005mol)时,转移电子为0.01mol,所以通过阳离子交换膜的阳离子的物质的量为0.01mol;在阴极发生2H+ + 2e- =H2↑,H+浓度减小,使得H2O OH- +H+的平衡向右移动,OH-浓度增大,pH增大
OH- +H+的平衡向右移动,OH-浓度增大,pH增大
(3)根据反应2ClO2+2CN- = N2↑+ 2CO2↑+2Cl-,n(ClO2)=n(CN-)=100×103L×a×10-3g/L÷26g/mol=3.85a。
考点:本题以工业流程为载体考查元素及其化合物性质、氧化还原方程式书写、电子转移计算、电解池等相关知识。


科目:高中化学 来源: 题型:
 二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂.
二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂.| 50a |
| 13 |
| 50a |
| 13 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源: 题型:
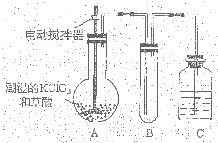 二氧化氯(ClO2)是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水.ClO2可以看做是亚氯酸(HClO2)和氯酸(HClO3)的混合酸酐.工业上用稍潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得.某学生拟用下图所示装置模拟工业制取及收集ClO2.(夹持仪器已省略).回答问题:
二氧化氯(ClO2)是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水.ClO2可以看做是亚氯酸(HClO2)和氯酸(HClO3)的混合酸酐.工业上用稍潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得.某学生拟用下图所示装置模拟工业制取及收集ClO2.(夹持仪器已省略).回答问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com