
| A. | 蒸发皿 | B. | 锥形瓶 | C. | 坩埚 | D. | 表面皿 |
科目:高中化学 来源: 题型:选择题
| A. | 1molNa与O2完全反应生成Na2O2和Na2O的混合物,转移电子的总数为NA | |
| B. | 室温下,31.0g白磷中含有的共价键数目为1.5NA | |
| C. | 常温常压下,17g甲基(-14CH3)含有的电子数为9NA | |
| D. | 常温下,1.0L pH=13的NaOH溶液中,由水电离的OH-离子数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
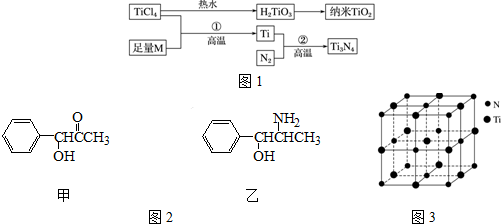
| I1 | I2 | I3 | I4 | I5 | |
| 电离能/kJ•mol-1 | 738 | 1451 | 7733 | 1054 0 | 13630 |
| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ•mol-1 | 786 | 715 | 3401 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 方法 | 需测定的数据 |
| ① | 测定产生的H2的体积 |
| ② | “测定残留固体镁的质量”或“测定反应消耗或剩余的NaOH的量”或“测定生成的NaAlO2的量” |
| 实验操作 | 预期现象和结论 |
| 步骤1: | |
| 步骤2: | |
| … |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeCl3 | B. | Na2SO4 | C. | Na2CO3 | D. | NaNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纯铁的抗腐蚀能力比生铁强 | |
| B. | 可用酒精洗涤附着在试管内壁上的固态硫 | |
| C. | 用惰性电极电解熔融NaCl可获得金属钠 | |
| D. | 二氧化硅能与NaOH溶液反应,所以盛放碱液的试剂瓶不能用磨口玻璃塞 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3.5×10-3 g | B. | 7×10-4 g | C. | 4.52×10-3 g | D. | 4.52×10-2 g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
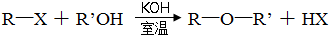 ,
,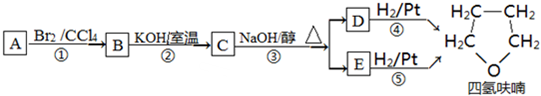
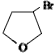 ,D
,D ,E
,E .
.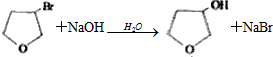 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
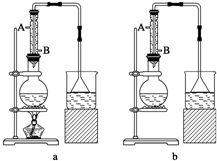
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com