
����Ŀ����˫����ѧ2017����ѧ�ڵڶ�����Ӧ�Կ��ԡ���������(NaClO2)����Һ�ж�����ClO2��HClO2��ClO2-��Cl-�ȣ�����HClO2��ClO2���Ǿ���Ư�����á���֪pOH=��lgc(OH-)�����ⶨ25��ʱ����ֺ�����pOH�仯�����ͼ��ʾ(Cl-û�л���)�����¶��£����з�����ȷ����

A��HClO2�ĵ���ƽ�ⳣ������ֵKa=10-8
B��pOH=11ʱ��ClO2-����ת����ClO2��Cl-���ӵķ���ʽΪ��5ClO2-+2H2O=4ClO2+ Cl-+4OH-
C��pH=7ʱ����Һ�к�������Ũ�ȴ�СΪ��c(HClO2)��c(ClO2-)��c(ClO2)��c(Cl-)
D��ͬŨ�ȵ�HClO2��Һ��NaClO2��Һ�������ϣ�������Һ����c(HClO2)+2c(H+)��c(ClO2-)+2c(OH-)
���𰸡�D
��������A��HClO2�ĵ���ƽ�ⳣ��K=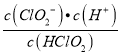 ���۲�ͼ����Կ�������pOH=8ʱ��pH=6��c(ClO2-)=c(HClO2)����ʱHClO2�ĵ���ƽ�ⳣ������ֵKa= c(H+)=10-6����A������B��pOH=11ʱ����Һ�����ԣ���������OH-����B����C������ͼ֪��pH=7ʱ������c(HClO2)��c( ClO2-)������Ũ�ȴ�С˳����c( ClO2-)��c(HClO2)��c( ClO2)��c( Cl-)����C����D�����ݵ�����ԭ��ó���c(H+)+c(Na+)��c(ClO2-)+c(OH-) �������������غ�ó���2c(Na+)��c(ClO2-)+c(HClO2) ���������٢���ȥ�����ӣ�c(HClO2)+2c(H+)��c(ClO2-)+2c(OH-)����D��ȷ����ѡD��
���۲�ͼ����Կ�������pOH=8ʱ��pH=6��c(ClO2-)=c(HClO2)����ʱHClO2�ĵ���ƽ�ⳣ������ֵKa= c(H+)=10-6����A������B��pOH=11ʱ����Һ�����ԣ���������OH-����B����C������ͼ֪��pH=7ʱ������c(HClO2)��c( ClO2-)������Ũ�ȴ�С˳����c( ClO2-)��c(HClO2)��c( ClO2)��c( Cl-)����C����D�����ݵ�����ԭ��ó���c(H+)+c(Na+)��c(ClO2-)+c(OH-) �������������غ�ó���2c(Na+)��c(ClO2-)+c(HClO2) ���������٢���ȥ�����ӣ�c(HClO2)+2c(H+)��c(ClO2-)+2c(OH-)����D��ȷ����ѡD��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��H2��ICl�ķ�Ӧ�֢١����������У���������������ͼ��ʾ�������й�˵������ȷ���ǣ� ��

A. ��Ӧ�ڱȢ�Ҫ����������Ϊ��Ӧ�ڻ�ܴ�
B. ��Ӧ�ٺ͢ھ�Ϊ���ȷ�Ӧ
C. H2(g)+2ICl(g)= I2(g)+2HCl(g) H= -218 kJ��mol��1
D. ��Ӧ�ٺ͢ھ�Ϊ������ԭ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȷ����( )
A. ͬ��ͬѹ�£���ͬ��������ʣ����ǵ����ʵ�������ͬ
B. ���³�ѹ�£���������N2��CO������������ͬ
C. VLO2������һ����VLCO2������С
D. A�����е�H2��B�����е�NH3����ԭ��������ȣ����������������Ϊ2��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������һ�����ʵ���Ũ�ȵ�NaCL��Һ�����в�����ʹ��ҺŨ��ƫ�ߵ���
A. ����NaCl��������ڳ���ֽ�� B. �ܽ�NaCl���ձ�������������ˮ
C. ת����Һʱû��ϴ���ձ��Ͳ����� D. ����ʱҺ����ߴ���̶�����ƽ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ�����У��й��Լ��ı��淽������ȷ����
A. ����̼��ƹ�����ڹ��ƿ�� B. ������ˮ��������ɫϸ��ƿ��
C. ���������Ʊ�����ú���� D. Ũ���ᱣ������ɫϸ��ƿ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ļ��������Ź㷺����;����ش��������⣺
��1������Ԫ�����ڱ��е�λ��Ϊ_________�������Ų�ʽ��________����Ԫ����������Ȼͬλ��10B��11B����Ԫ�صĽ������ԭ������Ϊ10.8��������ͬλ��ԭ�ӵ�ԭ�Ӹ���֮��Ϊ_______��
��2��������B����һ����������NaOH��Һ��Ӧ����NaBO2��һ�����壬��д���÷�Ӧ�Ļ�ѧ����ʽ________________��
��3�����ᣨH3BO3����һ�ְ�ɫƬ״���壬����ˮ���������������֯���źͻ��ķ����������á�������һԪ���ᣬ����ʱ0.1mol/L�����pHΪ5����������ĵ��볣��K��__________�������ᣨHBF4����һ��ǿ�ᣬ��������״̬������ˮ�У���д��BF4���ĵ���ʽ__________��
��4��B2H6�����һ����̬�⻯�����������飨C2H6�����ƶ�����Ϊ�����顣
�پ��ⶨB2H6��Bԭ�������Ҳ����8���ӽṹ���ɴ��Ʋ�B2H6��C2H6���ӽṹ_________�����ͬ������ͬ������
��B2H6����BF3��NaBH4��һ�������·�Ӧ�Ƶã�д���÷�Ӧ�Ļ�ѧ����ʽ_________��
��B2H6��ǿ��ԭ��������ˮ��Ӧ����H3BO3��H2������0.1mol B2H6��ˮ��ȫ��Ӧ�������H2�ڱ�״���µ����Ϊ_________L��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ָ����Ӧ�����ӷ���ʽ��ȷ������ ��
A. Ca(ClO)2��Һ��ͨ������SO2��Ca2++2ClO��+SO2+H2O=CaSO4��+H++Cl��+ HClO
B. ��FeCl2��Һ��������NaClO��Һ��6Fe2++3ClO��+3H2O=2Fe(OH)3��+4Fe3++3Cl��
C. NH4HCO3��Һ��������NaOH��Һ�����HCO![]() ��OH��===CO
��OH��===CO![]() ��H2O
��H2O
D. ��Fe(NO3)3��Һ�м���������HI��Һ��2Fe3��+2I�� = 2Fe2��+I2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȥ��2����ԭ���γ�һ��˫�������ȷ�Ӧ����Լ��117��125 kJ/mol����������1��3-������ϩʧȥ2����ԭ�ӱ�ɱ��Ƿ��ȷ�Ӧ����H=��23.4 kJ/mol��������ʵ����
A��1��3-������ϩ���������ȷ�Ӧ B�����������ɻ����������ȷ�Ӧ
C��l��3-������ϩ�ȱ��ȶ� D������1��3-������ϩ�ȶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������Ҫ�Ļ��������ѧ��ѧ������������������������������⣬���������Ρ�FeSO4��7H2O��һ��dz��ɫ���壬�׳��̷��������ڴ����������������ӵķ�ˮ�������̷���ij������ˮ(����ǿ����������Cr2O![]() )���д�����
)�������
(1)�̷��������������ᷴӦ�����⣬��ҵ�ϻ����ÿ�����ˮ��������(��Ҫ�ɷ�ΪFeS2)����ȡ����֪�÷�Ӧ����������������������һ����ѧ��ѧ������ǿ�ᣬ��д���÷�Ӧ�Ļ�ѧ����ʽ��
________________________________________________________________________��
(2)����ƽ��________Fe2����________Cr2O![]() ��________===________Fe3����________Cr3����________H2O
��________===________Fe3����________Cr3����________H2O
(3)���÷�ˮ��������Cr3���ĺ���Ϊ1��10��2 mol��m��3��������83.4 kg�̷����Դ����÷�ˮ________��(��֪��ˮ���ܶ�Ϊ1 g��cm��3)��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com