


科目:高中化学 来源: 题型:
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:

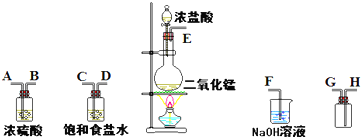
 MnCl2+Cl2+2H2O
MnCl2+Cl2+2H2O MnCl2+Cl2+2H2O
MnCl2+Cl2+2H2O查看答案和解析>>
科目:高中化学 来源: 题型:
(17分)已知:①A是石油裂解气的主要成份,A的产量通常用来衡量一个国家的石油化工水平;②2CH3CHO+O22CH3COOH。现以A为主要原料合成乙酸乙酯,其合成路线如下图所示。
回答下列问题:
(1)A的结构式为 。
(2)写出下列反应的反应类型:① ,② ,④ 。
(3)B、D分子中的官能团名称分别是 、 。
(4)除去乙酸乙酯中所混有少量的D杂质,所需试剂的名称是: 。
(5)写出下列反应的化学方程式:(注明反应条件)
① ;
② ;
④ 。
(6)若184gB和120gD反应能生成106gE,计算该反应的产率为 。
(7)判定B能否直接被氧化为D,若能,指出所用的氧化剂是什么 (若不能,此空不填);若不能请说明理由 (若能,此空不填)。
查看答案和解析>>
科目:高中化学 来源: 题型:
(16分)、(1)有机化合物的结构简式可进一步简化,如:
写出下列物质的分子式:
① 分子式 用系统命名法对该有机物进行命名_______________
② 分子式 ③
分子式
(2)除去下列物质中的杂质(括号内为杂质),填入所用试剂和分离方法。
①乙烯(SO2),试剂 ,分离方法
②苯(溴),试剂 ,分离方法
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com