
| 实验序号 | 甲 | 乙 | 丙 |
| 合金质量/mg | 255 | 385 | 510 |
| 气体体积/ml | 280 | 336 | 336 |
| 滤液中的溶质 | NaCl | NaAlO2 |
| 对应物质的量/mol | ||
| 加入NaOH溶液的体积/ml | ||
 =0.015mol,根据氢元素守恒可知n(HCl)=2n(H2)=2×0.015mol=0.03mol,故盐酸的物质的量浓度为
=0.015mol,根据氢元素守恒可知n(HCl)=2n(H2)=2×0.015mol=0.03mol,故盐酸的物质的量浓度为 =1mol/L.
=1mol/L. ×2,联立方程解得:x=0.005、y=0.005,故合金中镁与铝的物质的量之比为0.005mol:0.005mol=1:1.
×2,联立方程解得:x=0.005、y=0.005,故合金中镁与铝的物质的量之比为0.005mol:0.005mol=1:1. =306mg,故金属有剩余.
=306mg,故金属有剩余. =0.01mo,根据铝元素守恒计算偏铝酸钠的物质的量为0.01mol,根据氯离子守恒可知n(NaCl)=1mol/L×0.03L=0.03mol,根据钠离子守恒可知n(NaOH)=n(NaCl)+n(NaAlO2)=0.03mol+0.01mol=0.04mol,故需要氢氧化钠溶液的体积为
=0.01mo,根据铝元素守恒计算偏铝酸钠的物质的量为0.01mol,根据氯离子守恒可知n(NaCl)=1mol/L×0.03L=0.03mol,根据钠离子守恒可知n(NaOH)=n(NaCl)+n(NaAlO2)=0.03mol+0.01mol=0.04mol,故需要氢氧化钠溶液的体积为 =0.04L=40mL.
=0.04L=40mL.| 滤液中的溶质 | NaCl | NaAlO2 |
| 对应物质的量/mol | 0.03 | 0.01 |
| 加入NaOH溶液的体积/ml | 40 | |
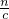 计算氢氧化钠的体积.
计算氢氧化钠的体积.

 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:
| 实验序号 | 甲 | 乙 | 丙 |
| 合金质量/mg | 255 | 385 | 510 |
| 气体体积/ml | 280 | 336 | 336 |
| 滤液中的溶质 | NaCl | NaAlO2 |
| 对应物质的量/mol | ||
| 加入NaOH溶液的体积/ml | ||
查看答案和解析>>
科目:高中化学 来源: 题型:
度的盐酸,加入不同质量的同一镁铝合金粉末,有关数据列表如下:
实验序号 | 甲 | 乙 | 丙 |
合金质量/mg | 510 | 765 | 918 |
气体体积/mL | 560 | 672 | 672 |
问:(1)盐酸的物质的量浓度是多少?
(2)求合金中镁、铝的质量分数。
(3)在丙实验之后,还需向容器中加入1.00 mol·L-1的NaOH溶液多少毫升才能使剩余合金中的铝全部溶解(设剩余合金与原合金成分相同)?
查看答案和解析>>
科目:高中化学 来源: 题型:
在标准状况下进行下列实验:甲、乙、丙各取100mL同浓度的盐酸,加入同一镁、铝合金,产生气体,测得有关数据列表如下:
| 实验序号 | 甲 | 乙 | 丙 |
| 合金质量 | 0.390g | 0.702g | 0.936g |
| 气体体积 | 448mL | 672mL | 672mL |
分析上表数据后计算:
(1) 盐酸的物质的量浓度
(2)合金中镁与铝的物质的量之比
(3)在实验甲反应后溶液中加入过量 0.2mol·L-1的NaOH溶液,欲使生成的沉淀最少,至少应加入多少毫升0.2mol·L-1的NaOH溶液?
查看答案和解析>>
科目:高中化学 来源:2011-2012学年山西省山大附中高一2月月考化学试卷 题型:计算题
在标准状况下进行下列实验:甲、乙、丙各取100mL同浓度的盐酸,加入同一镁、铝合金,产生气体,测得有关数据列表如下:
| 实验序号 | 甲 | 乙 | 丙 |
| 合金质量 | 0.390g | 0.702g | 0.936g |
| 气体体积 | 448mL | 672mL | 672mL |
 2mol·L-1的NaOH溶液,欲使生成的沉淀最少,至少应加入多少毫升0.2mol·L-1的NaOH溶液?
2mol·L-1的NaOH溶液,欲使生成的沉淀最少,至少应加入多少毫升0.2mol·L-1的NaOH溶液?查看答案和解析>>
科目:高中化学 来源:2014届山西省高一2月月考化学试卷 题型:计算题
在标准状况下进行下列实验:甲、乙、丙各取100mL同浓度的盐酸,加入同一镁、铝合金,产生气体,测得有关数据列表如下:
|
实验序号 |
甲 |
乙 |
丙 |
|
合金质量 |
0.390g |
0.702g |
0.936g |
|
气体体积 |
448mL |
672mL |
672mL |
分析上表数据后计算:
(1) 盐酸的物质的量浓度
(2)合金中镁与铝的物质的量之比
(3)在实验甲反应后溶液中加入过量 0.2mol·L-1的NaOH溶液,欲使生成的沉淀最少,至少应加入多少毫升0.2mol·L-1的NaOH溶液?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com