
按要求回答下列问题
(1)某温度下,纯水中c (H+)=2.0×10-7 mol·L-1,则此时c (OH-) = mol·L-1
0.9mol·L-1NaOH溶液与0.1mol·L-1HCl溶液等体积混合(不考虑溶液体积变化)后,溶液的pH=_____。
(2)向0.020 mol·L-1的HCN溶液中加入0.020 mol NaCN固体,溶液pH增大,主要原因是 ;已知该混合溶液中c (Na+) > c (CN-),则c (HCN) c (CN-)(用“>”、“<”、“=”符号填空)。
(3)向1L 0.10 mol·L-1的HCN溶液中加入0.08molNaOH固体,得到混合溶液,则_________和__________两种粒子的物质的量之和等于0.1mol;写出该混合溶液中存在的所有平衡的表达式 。
(1)2.0×10-7 (2分) ;13 (2分)
(2)CN-浓度增大,抑制了HCN的电离,使C(H+)降低,pH值增大,>(2分)
(3)HCN、 CN-(2分,少答一个不得分);
HCN  H++ CN-(1分);H2O
H++ CN-(1分);H2O  H+ + OH-(1分);CN-+ H2O
H+ + OH-(1分);CN-+ H2O HCN+ OH- (1分);
HCN+ OH- (1分);
解析试题分析:(1)纯水呈中性,即c (H+)="c" (OH-) =2.0×10-7 mol·L-1,Kw=4.0×10-14,0.9mol·L-1NaOH溶液与0.1mol·L-1HCl溶液等体积混合,
c (OH-) =(0.9-0.1)/2=0.4mol/L,故c (H+)="Kw/c" (OH-)=4.0×10-14/0.4mol/L=10-13mol/L,所以pH="-lgc" (H+)=13;(2)向0.020 mol·L-1的HCN溶液中加入0.020 mol NaCN固体,溶液pH增大,主要原因为CN-浓度增大,抑制了HCN的电离,使C(H+)降低,pH值增大,因为c (Na+) > c (CN-),根据电荷守恒c (H+)+c (Na+)="c" (CN-)+c (OH-),,即该溶液层碱性,所以HCN的电离小于水解,即c (HCN)>c (CN-);(3)根据物料守恒,可以知道)HCN、 CN两种粒子的物质的量之和等于0.1mol;该溶液为NaCN和HCN的混合溶液,所以混合溶液中存在的所有平衡的表达式为CN  H++ CN-;H2O
H++ CN-;H2O  H+ + OH-;CN-+ H2O
H+ + OH-;CN-+ H2O HCN+ OH- 。
HCN+ OH- 。
考点:水的离子积、盐类水解、电荷守恒、质子守恒、pH的计算
点评:本题综合考查了水的离子积、盐类水解、电荷守恒、质子守恒、pH的计算,有一定的综合性,该题有一定的难度。


 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 A、B、C、D都是由短周期元素组成的常见物质,其中A、B、C均含同一种元素,在一定条件下相互转化关系如图所示(部分产物已略去).
A、B、C、D都是由短周期元素组成的常见物质,其中A、B、C均含同一种元素,在一定条件下相互转化关系如图所示(部分产物已略去).| 催化剂 |
| △ |
| 催化剂 |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 H++CN-、H2O
H++CN-、H2O H++OH-、CN-+H2O
H++OH-、CN-+H2O HCN+OH-
HCN+OH- H++CN-、H2O
H++CN-、H2O H++OH-、CN-+H2O
H++OH-、CN-+H2O HCN+OH-
HCN+OH-查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
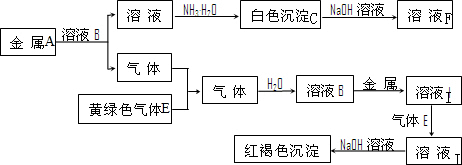
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com