
 工业上以乙苯催化脱氢制取苯乙烯的反应如下:
工业上以乙苯催化脱氢制取苯乙烯的反应如下: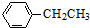 (g)$\stackrel{催化剂}{?}$
(g)$\stackrel{催化剂}{?}$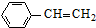 (g)+H2(g)
(g)+H2(g)| A. | 400℃时,向体系中通入水蒸气,v(正)、v(逆) 均减小,且乙苯转化率降低 | |
| B. | 500℃时,向体系中通入乙苯、苯乙烯、氢气各0.1x mol,平衡不移动 | |
| C. | 550℃时,用平衡分压代替平衡浓度表示的化学平衡常数Kp=$\frac{9}{16}$×p总 | |
| D. | 550℃时平衡体系中苯乙烯的体积分数是450℃时的3倍 |
分析 A、向体积可变的密闭容器中通入水蒸气,导致反应体系体积变大,反应物和生成的浓度都减小,v(正)、v(逆) 均减小,相当于减小压强,平衡正向移动;
B、向体系中通入乙苯、苯乙烯、氢气各0.1x mol,相当于减小压强,平衡正向移动;
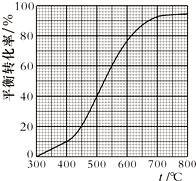
C、由图可知550℃时,乙苯的平衡转化率为:60%,应用三行式,结合气体分压(p分)=气体总压(p总)×体积分数;
D、由图可知550℃时平衡体系中苯乙烯的转化率率为:60%,450℃时平衡体系中苯乙烯的转化率率为:20%.
解答 解:A、向体积可变的密闭容器中通入水蒸气,导致反应体系体积变大,反应物和生成的浓度都减小,v(正)、v(逆) 均减小,相当于减小压强,平衡正向移动,所以乙苯转化率升高,故A错误;
B、向体系中通入乙苯、苯乙烯、氢气各0.1x mol,相当于减小压强,平衡正向移动,而不是不移动,故B错误;
C、由图可知500℃时,乙苯的平衡转化率为:60%,应用三行式,
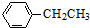 (g)$\stackrel{催化剂}{?}$
(g)$\stackrel{催化剂}{?}$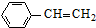 (g)+H2(g)
(g)+H2(g)
初起量:x mol 0 0
变化量:0.6xmol 0.6xmol 0.6xmol
平衡量:0.4xmol 0.6xmol 0.6xmol
所以K=$\frac{(\frac{0.6}{1.6}{×p}_{总})^{2}}{\frac{0.4}{1.6}×{p}_{总}}$=$\frac{9}{16}$×p总,故C正确;
D、由图可知550℃时平衡体系中苯乙烯的转化率率为:60%,450℃时平衡体系中苯乙烯的转化率率为:20%,所以550℃时平衡体系中苯乙烯的体积分数是450℃时的2倍,故D错误;
故选C.
点评 本题考查较综合,涉及平衡常数的计算、转化率的计算等知识点,侧重考查计算、基本理论,会利用三段式法进行分析解答,题目难度不大.


 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案科目:高中化学 来源: 题型:选择题
| A. | 化学反应放热是因为反应物的总能量低于生成物的总能量 | |
| B. | 不需要加热就能发生的反应是放热反应 | |
| C. | 化学能是能量的一种形式,它不仅可以转化为热能,也能转化为电能 | |
| D. | 氯化钠晶体熔化时,离子键被破坏,吸收能量,发生化学变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
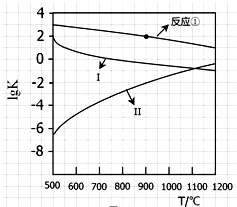 用CaSO4代替O2与燃料CO反应,既可提高燃烧效率,又能得到高纯CO2,是一种高效、清洁、经济的新型燃烧技术,反应①为主反应,反应②和③为副反应.
用CaSO4代替O2与燃料CO反应,既可提高燃烧效率,又能得到高纯CO2,是一种高效、清洁、经济的新型燃烧技术,反应①为主反应,反应②和③为副反应. .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | x+y<z | B. | 平衡向正反应方向移动 | ||
| C. | B的浓度降低 | D. | C的体积分数下降 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
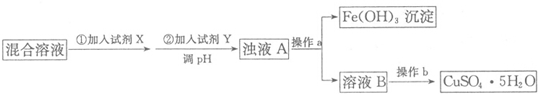
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| 开始沉淀的pH | 1.9 | 6.5 | 4.7 |
| 沉淀完全的pH | 3.7 | 9.7 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | ①图象中如果纵坐标为正反应速率,则t时刻改变的条件可以为升温或加压 | |
| B. | ②图象中纵坐标可以为镓的转化率 | |
| C. | ③图象中纵坐标可以为化学反应速率 | |
| D. | ④图象中纵坐标可以为体系内混合气体平均相对分子质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 难溶电解质 | Mg(OH)2 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 溶解度/g | 9×10-4 | 1.7×10-6 | 1.5×10-4 | 3.0×10-9 |
| 沉淀完全时的pH | 11.1 | 6.7 | 9.6 | 3.7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com