
 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案科目:高中化学 来源: 题型:阅读理解
| n(SO32-):n(HSO3-) | 91:9 | 1:l | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |

| 催化剂 |
| 8 |
| 3 |
| 8 |
| 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 (2010?祁阳县一模)一氧化碳、二氧化硫和氮的氧物是重要的化工原料,但也是大气的主要污染物,综合治理其污染是环境化学当前的重要研究内容之一.
(2010?祁阳县一模)一氧化碳、二氧化硫和氮的氧物是重要的化工原料,但也是大气的主要污染物,综合治理其污染是环境化学当前的重要研究内容之一.查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 催化剂 |
查看答案和解析>>
科目:高中化学 来源:2013-2014学年东北三省四市高三第一次模拟考试理综化学试卷(解析版) 题型:填空题
2013年初,全国各地多个城市都遭遇“十面霾伏”,造成“阴霾天”的主要根源之一是汽车尾气和燃煤尾气排放出来的固体小颗粒。
汽车尾气净化的主要原理为:2NO(g)+2CO(g)  2CO2+N2。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线如下图所示。据此判断:
2CO2+N2。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线如下图所示。据此判断:

(1)该反应为 反应(填“放热”或“吸热”):在T2温度下,0~2s内的平均反应速率:v(N2)= ;(2)当固体催化剂的质量一定时,增大其表面积可提高化学反应速率。若催化剂的表面积S1>S2,在答题卡上画出 c(CO2)在T1、S2条件下达到平衡过程中的变化曲线。
(3)某科研机构,在t1℃下,体积恒定的密闭容器中,用气体传感器测得了不同时间的NO和CO的浓度(具体数据见下表,CO2和N2的起始浓度为0)。
|
时间/s |
0 |
1 |
2 |
3 |
4 |
5 |
|
c(NO)/xl0-4 mol L-1 |
10.0 |
4.50 |
2.50 |
1.50 |
1.00 |
1.00 |
|
c(CO)/xl0-3 mol L-1 |
3.60 |
3.05 |
2.85 |
2.75 |
2.70 |
2.70 |
t1℃时该反应的平衡常数K= ,平衡时NO的体积分数为 。
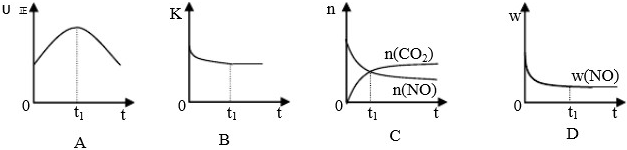
(4)若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是 (填代号)。(下图中v正、K、n、m分别表示正反应速率、平衡常数、物质的量和质量)

(5)煤燃烧产生的烟气也含氮的氧化物,用CH4催化还原NOX可以消除氮氧化物的污染。
已知:CH4(g)+2NO2(g) = N2 (g)+CO2 (g)+2H2O(g) △H=-867.0 kJ • mol-1
2NO2 (g)  N2O4
(g)
△H=-56.9 kJ • mol-1
N2O4
(g)
△H=-56.9 kJ • mol-1
H2O(g) = H2O(l) △H=-44.0 kJ • mol-1
写出CH4催化还原N2O4 (g)生成N2 (g)、CO2 (g)和H2O(l)的热化学方程式 。
查看答案和解析>>
科目:高中化学 来源:2013届福建省高二上学期期中考试化学试卷 题型:选择题
(11分)
Ⅰ.(8分)氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:

(1)配平上述反应的化学方程式(将化学计量数填在方框内);
(2)若知上述反应每产生2.24LCO气体(折为标准状况)放出Q kJ的热量,则其热化学方程式为
(3)用轨道表示式表达Si 核外电子排布情况
(4)已知Si的电负性为1.8 ,H的电负性为2.1,N的电负性为3.0 ,则SiH4 中硅的化合价为 ,Si3N4所属的化合物类型是 (填离子化合物or共价化合物),在前四周期的元素中,未成对电子数最多的元素的电子排布式为
Ⅱ.(3分)用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1
2N2(g)+CO2(g)+2H2O(g)=CH4(g)+4NO(g) ΔH=+1160 kJ·mol-1
若用标准状况下4.48LCH4还原NO2至N2 ,整个过程中转移的电子总数为 (阿伏伽德罗常数用NA表示),放出的热量为 kJ。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com