
| A. | 常温下SO3是液体 | |
| B. | 标准状况下,1 mol SO3的体积约为22.4L | |
| C. | SO3与CaO反应生成CaSO3 | |
| D. | SO2遇空气即生成SO3 |
分析 A.三氧化硫的熔点为16.8℃,则常温下为液体;
B.标准状况下,气体的摩尔体积为22.4L/mol;
C.SO3与CaO发生化合反应;
D.SO2发生催化氧化生成SO3.
解答 解:A.三氧化硫的熔点为16.8℃,则常温25℃下为液体,故A正确;
B.标准状况下,气体的摩尔体积为22.4L/mol,不能计算1 mol SO3的体积,故B错误;
C.SO3与CaO发生化合反应生成CaSO4,故C错误;
D.SO2发生催化氧化生成SO3,在空气中不反应,故D错误;
故选A.
点评 本题考查物质的性质,为高频考点,把握物质的性质、发生的反应为解答的关键,侧重分析与应用能力的考查,注意物质的状态及物质的量的相关计算,题目难度不大.


 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案 全优冲刺100分系列答案
全优冲刺100分系列答案科目:高中化学 来源: 题型:解答题
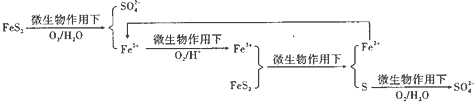
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:3 | B. | 1:4 | C. | 1:5 | D. | 1:6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ③④⑤ | C. | ②③⑤ | D. | ②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,44.8L乙醇中含有的分子数目为0.2NA | |
| B. | 常温常压下,6.4gSO2中含有的氧原子数目为0.2NA | |
| C. | 1L0.1mol•L-1K2CO3溶液中含有的钾离子数目为0.1NA | |
| D. | 100mL1.0mol•L-1FeCl3溶液与足量铜反应,转移的电子数目为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
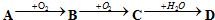
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t/min | 2 | 4 | 7 | 9 |
| n(H2O)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com