
分析 (1)方程式可知,当有1molMnO2参加反应,有4molHCl参加反应,但生成1molCl2,说明有2molHCl被氧化,n(MnO2)=$\frac{17.4g}{87g/mol}$=0.2mol,结合反应的方程式计算;
(2)根据化合价的升降结合反应掉的盐酸的物质的量进行计算;
(3)反应中亚硫酸钠中的硫元素化合价升高,Cl化合价降低,根据电子守恒计算即可.
解答 解:(1)n(MnO2)=$\frac{17.4g}{87g/mol}$=0.2mol,
MnO2 +4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O 被氧化HCl
1 4 2
0.2mol 0.8mol 0.4mol
则参加反应的HCl的物质的量为0.8mol,质量为0.8mol×36.5g/mol=29.2g,
由以上分析可知,被氧化的氯化氢的质量为0.4mol×36.5g/mol=14.6g,
(2)参加反应的HCl的物质的量为0.8mol,被氧化HCl0.4mol,所以转移电子的物质的量为0.4mol,故答案为:0.4mol;
(3)参加反应的HCl的物质的量为0.8mol,产生氯气是0.4mol,反应中亚硫酸钠中的硫元素化合价升高,Cl化合价降低,设需要Na2SO3的物质的量是x,根据电子守恒,x(6-4)=0.4mol×2(1-0),解得x=0.4mol,需要Na2SO3的质量是:0.4mol×126g/mol=50.4g,故答案为:50.4g.
点评 本题考查学生氧化还原反应中的基本概念以及电子转移的有关计算知识,属于综合知识的考查,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 烷烃同系物随相对分子质量增大,熔点、沸点逐渐升高;常温下的状态由气态递变到液态,相对分子质量大的则为固态 | |
| B. | 烷烃同系物都能使溴水、KMnO4溶液褪色 | |
| C. | 烷烃跟卤素单质在光照条件下能发生取代反应 | |
| D. | 烷烃同系物的密度随相对分子质量增大逐渐增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向 FeBr2溶液中通入足量氯气:2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl- | |
| B. | NaClO溶液 FeCl2溶液混合 2ClO-+Fe2++2H2O=Fe(OH)2↓+2HClO | |
| C. | 在强碱中NaClO与Fe(OH)3生成Na2FeO4:3ClO-+2Fe(OH)3═2FeO${\;}_{4}^{2-}$+3Cl-+H2O+4H+ | |
| D. | 用铜做电极电解 CuSO4溶液:2Cu2++2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu↓+O2↑+4H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③⑤⑥ | B. | ①②⑤⑥⑦ | C. | ①③④⑥ | D. | ②⑤⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 电解过程中,d电极附近溶液变红 | |
| B. | c电极上的电极反应式为:2H++2e-=2H2↑ | |
| C. | a为负极、d为阳极 | |
| D. | 电解过程中,氯离子浓度不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
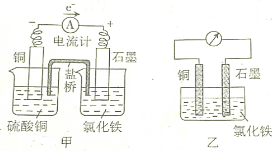
| A. | 甲、乙装置中的负极(或正极)反应式不同 | |
| B. | 放电少许时间后,甲、乙装置石墨极质量均增加 | |
| C. | 放电少许时间后,甲装置左边烧杯中含有两种溶质 | |
| D. | 甲、乙装置的能量转化形式不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol•L-1NH4HCO3溶液中:c(NH4+)+c(H+)=c(OH-)+c(HCO3-) | |
| B. | 向NaAlO2溶液中滴加NaHCO3溶液,有沉淀和气体生成 | |
| C. | NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同 | |
| D. | 欲使Na2S溶液中c(Na+)于c(S2-)的比值恰好为2:1,可加入适量的KHS溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
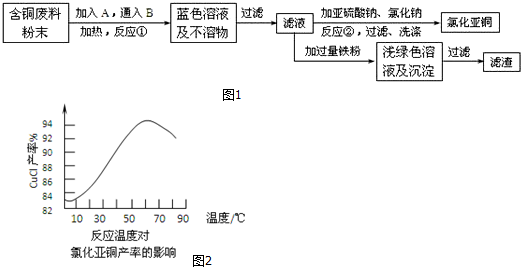
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com