

分析 (1)①根据物质的量的变化判断反应物和生成物,根据物质的量的变化之比等于化学计量数之比书写方程式;
②分析图象计算Z的消耗物质的量为0.2mol,结合反应速率概念计算,V=$\frac{△c}{△t}$;
③2min时X的转化率=$\frac{消耗量}{起始量}$×100%;
(2)①由图象可知0.1000mol L-1的一元酸HA溶液pH约为4,可证明HA为弱酸,据此写出反应的离子方程式;
②图中②点酸过量,溶液呈酸性,结合物料守恒和电荷守恒解答该题;
③由于HA为弱酸,③点时溶液呈中性,加入NaOH体积应小于20.00mL.
解答 解:(1)①由图象可以看出,反应中X、Y的物质的量减小,Z的物质的量增多,则X、Y为反应物,Z为生成物,且△n(X):△n(Y):△n(Z)=(1mol-0.7mol):(1mol-0.8mol):0.3=0.3mol:0.2mol:0.3mol=3:2:3,则反应的化学方程式为:3X+2Y?3Z,
故答案为:3X+2Y?3Z;
②图象计算Z的生成物质的量为0.3mol,从开始至2min,Z的平均反应速率=$\frac{\frac{0.3mol}{2L}}{2min}$=0.075mol/(L•min);
故答案为:0.075;
③2min时X的转化率=$\frac{1.0mol-0.7mol}{1.0mol}$×100%=30%,
故答案为:30%;
(2)①由图象可知0.1000mol L-1的一元酸HA溶液pH约为4,说明HA为弱酸,则发生反应的离子方程式为:HA+OH-=A-+H2O,
故答案为:HA+OH-=A-+H2O;
②a、②点时加入NaOH物质的量为HA的物质的量的一半,由物料守恒可知:2c(Na+)=c(HA)+c(A-),故正确;
b、根据电荷守恒可知:c(Na+)+c(H+)=c(A-)+c(OH-),故正确;
c、②点时加入热NaOH物质的量为HA的物质的量的一半,反应后溶质为等浓度的NaA和HA,混合液呈酸性,则A-的水解程度小于HA的电离程度,则c(A-)>c(Na+),故错误;
故答案为:ab;
③由于HA为弱酸,③点时溶液呈中性,加入NaOH体积应小于20.00mL,
故答案为:<.
点评 本题考查了化学反应速率的计算应用、酸碱混合的定性判断及溶液pH的计算等,图象分析和反应进行方向的判断方法是解题关键,根据图象判断HA为弱酸为解答该题的关键,注意掌握酸碱混合的定性判断及pH的计算方法,明确离子浓度大小的判断方法.


 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等于8.0g | B. | 等于8.00g | C. | 大于8.0g | D. | 等于0.2g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AY溶液的pH小于7 | |
| B. | AY溶液的pH小于BY溶液的pH | |
| C. | 稀释相同倍数,BX溶液的pH变化小于BY溶液 | |
| D. | 电离平衡常数K(BOH)小于K(HY) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某研究性学习小组设计了一组实验验证元素周期律.
某研究性学习小组设计了一组实验验证元素周期律.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
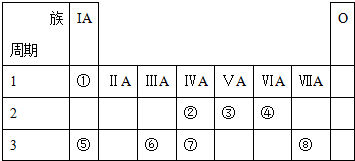
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
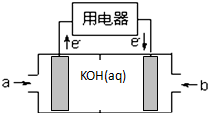 现有部分短周期元素的性质或原子结构如表:
现有部分短周期元素的性质或原子结构如表:| 元素编号 | 元素性质或原子结构 |
| A | 原子序数最小的元素 |
| B | 最外层电子数是次外层电子数的2倍 |
| C | 最外层电子数比次外层电子数多3 |
| D | 单质的一种同素异形体是保护地球地表环境的重要屏障 |
| E | 最高正化合价为+7 |
| F | 第3周期元素原子半径 最大 |
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题


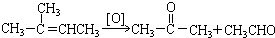
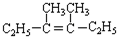 在上述类似条件下发生反应,请写出反应的方程式
在上述类似条件下发生反应,请写出反应的方程式 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com