
【题目】雾霾由多种污染物形成,其中包含颗粒物(包括PM 2.5在内)、氮氧化物(NOx)、CO、SO2等。化学在解决雾霾污染中有着重要的作用。
⑴ 已知:2SO2(g) + O2(g) ![]() 2SO3(g) △H =﹣196.6kJmol-1
2SO3(g) △H =﹣196.6kJmol-1
2NO(g) + O2(g) ![]() 2NO2(g) △H =﹣113.0kJmol-1
2NO2(g) △H =﹣113.0kJmol-1
则反应NO2(g) + SO2(g) ![]() SO3(g) + NO(g) △H =__________kJmol-1。
SO3(g) + NO(g) △H =__________kJmol-1。
一定条件下,将NO2与SO2以体积比1:2置于恒温恒容的密闭容器中发生上述反应,下列能说明反应达到平衡状态的有__________。
a、体系密度保持不变 b、混合气体颜色保持不变
c、SO2和NO的体积比保持不变 d、每消耗1mol SO3的同时生成1mol NO2
测得上述反应平衡时NO2与SO2体积比为1:5,则平衡常数K=________________。
⑵ CO、CO2都可用于合成甲醇。甲醇既是重要的化工原料,又可作为燃料,近几年开发的甲醇燃料电池采用铂作电极催化剂,电池中的质子交换膜只允许质子和水分子通过。其工作原理的示意图如图1所示,回答下列问题。
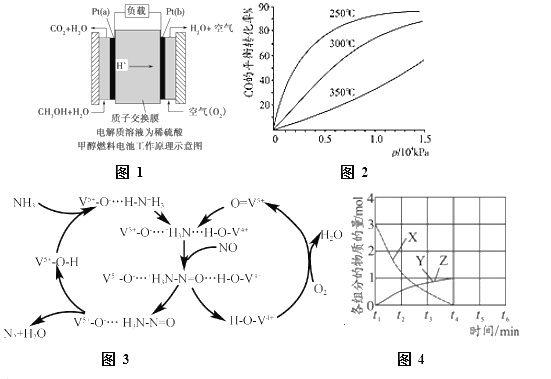
① Pt(a)电极是电池的______极,电极反应式为:_________________。
② 如果该电池工作时电路中通过2 mol电子,则消耗的CH3OH有________mol。
③ CO用于合成甲醇反应方程式为:CO(g) + 2H2(g)![]() CH3OH (g) ,CO在不同温度下的平衡转化率与压强的关系如图2所示。实际的生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是____________。
CH3OH (g) ,CO在不同温度下的平衡转化率与压强的关系如图2所示。实际的生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是____________。
⑶ 图3是一种用NH3脱除烟气中NO的原理。
① 该脱硝原理中,NO最终转化为H2O和__________(填化学式)。
② 当消耗2mol NH3和0.5mol O2时,除去的NO在标准状况下的体积为__________L。
⑷ NO直接催化分解(生成N2和O2)也是一种脱硝途径。在不同条件下,NO的分解产物不同。在高压下,NO在40℃下分解生成两种化合物,体系中各组分物质的量随时间变化曲线如图4所示,写出NO分解的化学方程式______________。
【答案】﹣41.8kJ/mol bc 1.8 负 2CH3OH+2H2O-12e-=2CO2↑+12H+ 1/3 此压强下CO的转化率已较高,再增大压强转化率提高不大且会增加生产成本 N2 44.8 L 3NO ![]() N2O + NO2
N2O + NO2
【解析】
(1)①2SO2(g) + O2(g) ![]() 2SO3(g),②2NO(g) + O2(g)
2SO3(g),②2NO(g) + O2(g) ![]() 2NO2(g),根据目标反应方程式,根据盖斯定律,(①-②)/2得出△H=(-196.6kJ·mol-1+113.0kJ·mol-1)/2=-41.8kJ·mol-1;a、组分都是气体,气体质量不变,容器为恒容,因此任何时刻气体密度都不变,因此密度不变,不能说明反应达到平衡,故a不符合题意;
2NO2(g),根据目标反应方程式,根据盖斯定律,(①-②)/2得出△H=(-196.6kJ·mol-1+113.0kJ·mol-1)/2=-41.8kJ·mol-1;a、组分都是气体,气体质量不变,容器为恒容,因此任何时刻气体密度都不变,因此密度不变,不能说明反应达到平衡,故a不符合题意;
b、NO2为红棕色气体,其余气体为无色,因此当气体颜色不再改变,说明反应达到平衡,故b符合题意;
c、SO2是反应物,NO为生成物,因此当SO2和NO的体积比保持不变,说明反应达到平衡,故c符合题意;
d、消耗SO3,生成NO2都是向逆反应方向进行,不能说明反应达到平衡,故d不符合题意;
令NO2的物质的量为1mol,SO2的物质的量为2mol,NO2(g) + SO2(g) ![]() SO3(g) + NO(g)
SO3(g) + NO(g)
起始: 1 2 0 0
变化: x x x x
平衡:1-x 2-x x x
(1-x):(2-x)=1:5,解得x=0.75,四种物质的系数都是1,因此有K=![]() =1.8;
=1.8;
(2)①Pt(a)一极通入CH3OH和H2O,转化成CO2和H2O,C的化合价-2价→+4价,化合价升高,根据原电池工作原理,Pt(a)为负极,其电极反应式为CH3OH+H2O-6e-=CO2↑+6H+;
②根据①电极反应式,通过2mole-,消耗CH3OH物质的量为2mol/6=1/3mol;
③根据图2,此压强下CO的转化率已较高,再增大压强,转化率提高并不大,会增加生产成本;
(3)①根据图3,NH3最终转化为H2O和N2;
②根据转化关系,NH3中N的化合价升高,NO和O2中化合价降低,根据得失电子数目守恒,2mol×[0-(-3)]=0.5mol×2×[0-(-2)]+n(NO)×(2-0),解得n(NH3)=2mol,标准状况下,V(NO)=2mol×22.4L·mol-1=44.8L;
(4)NO分解生成两种化合物,NO为反应物,根据图4,NO的物质的量为3mol,Y和Z为生成物,且物质的量为1mol,根据氮元素守恒,生成物中含有N2O,N的化合价降低,必然有化合价升高,即另一种产物是NO2,因此化学反应方程式为3NO![]() N2O+NO2。
N2O+NO2。


 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正确的是
A. 钠与水反应:2Na +2H2O = 2Na++2OH-+H2↑
B. 氯气通入水中:Cl2 +H2O= 2H++ClO-+Cl-
C. 硫酸溶液与氢氧化钡溶液:H+ + SO42- + Ba2++ OH-=BaSO4↓ + H2O
D. Na2O 加入稀硫酸中:O2-+2H+ = H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,对于可逆反应X(g)+3Y(g)![]() 2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达平衡时,X、Y、Z的浓度分别为0.1 mol/L、0.3 mol/L、0.08 mol/L,则下列判断正确的是 ( )
2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达平衡时,X、Y、Z的浓度分别为0.1 mol/L、0.3 mol/L、0.08 mol/L,则下列判断正确的是 ( )
A. c1:c2=3∶1 B. 平衡时,Y和Z的生成速率之比为2∶3
C. X、Y的转化率不相等 D. c1的取值范围为0 mol/L<c1 <0.14 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】体积相同的甲、乙两个容器中,分别都充有等物质的量的SO2和O2,在相同温度下发生反应:2SO2 + O2![]() 2SO3,并达到平衡。在这过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率
2SO3,并达到平衡。在这过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率
A. 等于p%B. 大于p%C. 小于p%D. 无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向50mLNaOH溶液中逐渐通入一定量的CO2(假设溶液体积不变),随后取此溶液10mL,将其稀释至100mL,并向此稀释后的溶液中逐滴加入0.1mol·L-1的盐酸,产生CO2气体的体积(标准状况下)与所加入的盐酸的体积关系如图,下列分析错误的是
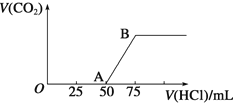
A. OA段所发生反应的离子方程式:H+ + OH-= H2O
B. 产生的CO2体积(标准状况下)为0.056L
C. 原NaOH溶液的物质的量浓度为0.75mol·L-1
D. NaOH在吸收CO2后,所得溶液的溶质为NaOH和Na2CO3,其物质的量浓度之比为1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅蓄电池是常见的二次电池,电池总反应为:Pb+PbO2+2H2S4![]() 2PbSO4+2H2O,下列说法正确的是
2PbSO4+2H2O,下列说法正确的是
A. 放电时的负极反应式为Pb+SO42- -2e-=PbSO4
B. 充电时铅蓄电池的正极与外接电源的负极相连
C. 放电时PbO2发生氧化反应
D. 充电时的阴极反应式为PbSO4+2H2O-2e-=PbO2+SO42-+4H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是一种以液态肼(N2H4)为燃料,氧气为氧化剂,某固体氧化物为电解质的新型燃料电池。该固体氧化物电解质的工作温度高达700—900℃时,O2-可在该固体氧化物电解质中自由移动,反应生成物均为无毒无害的物质。下列说法正确的是

A. 电池总反应为N2H4+2O2=2NO+2H2O
B. 电池内的O2-由电极乙移向电极甲
C. 电极乙上反应的电极方程式为:O2+2e-=O2-
D. 电池外电路的电子由电极乙移向电极甲
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家一直致力于“人工固氮”的研究,现已有多种方法。
(方法一)
1918年,德国化学家哈伯因发明工业合成氨的方法而荣获诺贝尔化学奖。
(1)若将1 mol N2和3 mol H2放入1L的密闭容器中,5min后N2的浓度为0.8mol/L,这段时间内用N2的浓度变化表示的反应速率为________mol/(L·min)。
(2)在一定温度下的定容密闭容器中发生上述反应,下列叙述能说明反应已经达到平衡状态的是________________。
a. υ(N2)正=3υ(H2)逆
b. 容器中气体的密度不随时间而变化
c. 容器中气体的分子总数不随时间而变化
d. 容器中气体的平均相对分子质量不随时间而变化
(3)若1 mol N2完全转化为NH3的反应热为![]() H=-92 kJ/mol,拆开1 mol H—H键和1 mol N
H=-92 kJ/mol,拆开1 mol H—H键和1 mol N![]() N 键需要的能量分别是436 kJ和946 kJ,则拆开1 mol N—H键需要的能量是__________kJ。
N 键需要的能量分别是436 kJ和946 kJ,则拆开1 mol N—H键需要的能量是__________kJ。
(4)合成氨反应的生产条件选择中,能用勒夏特列原理解释的是________________。
①使用催化剂 ②高温 ③高压 ④及时将氨气液化从体系中分离出来
A. ①③ B. ②③ C. ③④ D. ②④
(方法二)
1998年,两位希腊化学家提出了电解合成氨的新思路:
采用高质子导电性的SCY陶瓷(能传递H+)为介质,实现了高温(570℃)常压下高转化率的电解法合成氨,转化率可达到78%,装置如下图:
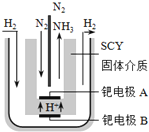
钯电极A是电解池的________极(填“阳”或“阴”),阳极反应式为__________________。
(方法三)
最新的“人工固氮”研究报道:在常温、常压、光照条件下,N2在催化剂表面与水发生反应,直接生成氨气和氧气:
已知:N2(g)+3H2(g)![]() 2NH3(g)
2NH3(g) ![]() H=-92 kJ/mol
H=-92 kJ/mol
2H2(g)+O2(g)=2H2O(1) ![]() H=-571.6 kJ/mol
H=-571.6 kJ/mol
写出上述固氮反应的热化学方程式________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列颜色变化与氧化还原反应无关的是( )
A. FeCl3溶液滴入Mg(OH)2浊液,白色浊液转化为红褐色沉淀
B. AgNO3溶液滴入氯水中,产生白色沉淀,随后淡黄色褪去
C. Na放在坩埚里并加热,发生黄色火焰,生成淡黄色固体
D. H2C2O4溶液滴入KMnO4酸性溶液中,产生气泡,随后紫色褪去
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com