
| A. | 电解水 | B. | 酸、碱的中和反应 | ||
| C. | 冰雪融化 | D. | 绿色植物的光合作用 |
 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 根据电解质的电离程度数据推测电解质溶液的导电性 | |
| B. | 用分子所具有能量数据分析分子的稳定性 | |
| C. | 应用固体溶解度数据判断某些复分解反应能否进行 | |
| D. | 利用电解质的电离常数判断某些酸式盐的水溶液的酸碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 微粒半径:O2-<F-<Na+<Li+ | |
| B. | 晶格能由大到小:NaI>NaBr>NaCl>NaF | |
| C. | 分子中的键角:CH4>H2O>CO2 | |
| D. | 共价键的键能:C-C>C-Si>Si-Si |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 与葡萄糖互为同分异构体 | |
| B. | 既可以与氧气反应,也可以与新制氢氧化铜反应 | |
| C. | 1个核糖分子可以与4个乙酸分子发生取代反应 | |
| D. | 不能使紫色石蕊试液变红 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
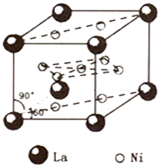 镍(Ni)是一种重要的金属,在材料科学等领域有广泛应用.
镍(Ni)是一种重要的金属,在材料科学等领域有广泛应用.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 44g | B. | 0.335mol | C. | 29.48g | D. | 0.5mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验 | 现象 | 结论 |
| A. | 将稀硝酸加入过量铁粉中,充分反应后滴加KSCN溶液 | 有气体生成,溶液呈血红色 | 稀硝酸将Fe氧化为Fe3+ |
| B. | 将水蒸气通过灼热的铁粉 | 粉末变红 | 铁与水在高温下发生反应 |
| C. | AgI沉淀中滴加稀KCl溶液 | 有白色沉淀出现 | AgCl的溶度积比AgI的小 |
| D. | 去少量无色溶液,先滴加氯水,再加入少量CCl4,振荡,静置 | 溶液分层,下层呈橙红色 | 原无色溶液中含有溴离子 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
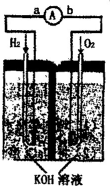 氢氧燃料电池是符合绿色化学理念的新型发电装置.如图为电池示意图,该电池电极表面镀一层细小的铂粉,吸附气体的能力强,性质稳定.请回答:
氢氧燃料电池是符合绿色化学理念的新型发电装置.如图为电池示意图,该电池电极表面镀一层细小的铂粉,吸附气体的能力强,性质稳定.请回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com