
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | |||||||
| 2 | D | E | G | I | ||||
| 3 | B | C | F | H |
分析 由元素在周期表中的位置可知,A为H,B为Na,C为Al,D为C,E为N,F为P,G为F,H为S,I为Ne,然后利用元素及其单质、化合物的性质来解答.
解答 解:(1)表中元素,化学性质最不活泼的是I为Ne,只有负价而无正价的是G为F,氧化性最强的单质是非金属性最强的氟气,还原性最强的单质是金属性最强的钠,故答案为:Ne;F;F2;Na;
(2)H分别与C、N、P、F、S形成的化合物中显碱性的是NH3,最稳定的是非金属性最强的氟,形成的HF,故答案为:NH3;HF;
(3)在Na、Al,C,N,P,F,S中,电子层越多半径越大,电子层相同,核电核数越多半径越小,所以原子半径最大的是第三周期的Na,故答案为:Na;
(4)Na、Al、S三种元素的最高价氧化物对应水化物两两间反应的化学方程式分别为Al(OH)3+NaOH=NaAlO2+2H2O;H2SO4+2NaOH=Na2SO4+2H2O;2Al(OH)3+3H2SO4=Al2(SO4)3+6H2O,故答案为:Al(OH)3+NaOH=NaAlO2+2H2O;H2SO4+2NaOH=Na2SO4+2H2O;2Al(OH)3+3H2SO4=Al2(SO4)3+6H2O.
点评 本题考查元素周期表和元素周期律,明确元素在周期表中的位置是解答本题的关键,然后利用单质、化合物的性质来解答即可,难度不大.


 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:解答题
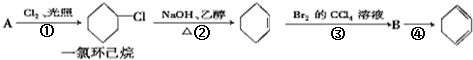
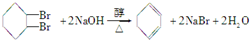 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO和H2中至少有一种 | B. | 肯定没有Cl2和HCl | ||
| C. | 肯定有SO2 | D. | 不能确定有无Cl2、HCl、SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放电时,正极发生的反应是Pb+SO42-+2e-═PbSO4 | |
| B. | 放电时,该电池的负极材料是铅板 | |
| C. | 放电时,电池中硫酸的浓度不断变小 | |
| D. | 放电时,每当消耗1 mol铅时转移电子2 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
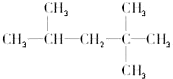 现有化合物A是汽油燃烧抗震性能的参照物,它的结构式如图:
现有化合物A是汽油燃烧抗震性能的参照物,它的结构式如图:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ④⑤⑥ | C. | ②④⑥ | D. | ②③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
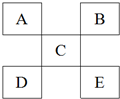
| A. | 如果D是金属元素,那么D元素的金属性比C强 | |
| B. | 元素C的最高价氧化物对应的水化物一定是强酸 | |
| C. | 元素B与氢形成的化合物中只能存在极性共价键 | |
| D. | 若E为非金属,则E的非金属性要强于B |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com