
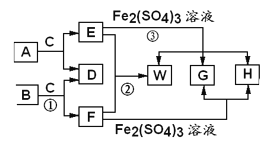
����Ŀ��WΪij������Ԫ��X�Ĺ�̬���ʣ�E�����ڱ�״���µ��ܶ�Ϊ1.52g/L��A��B��C��Ϊ��XԪ�ص���ʽ���Σ�������һ������������ͼ��ʾ��ת����ϵ������ijЩ��Ӧ�����е�H2O����ȥ��
��1������Xԭ�ӵ�ԭ�ӽṹʾ��ͼ________ A�ĵ���ʽ�ɱ�ʾΪ___________��
��2��д����Ӧ�ٵ����ӷ�Ӧ����ʽ___________��
��3��д����Ӧ�ڵĻ�ѧ��Ӧ����ʽ_______________________________________��
��4��д����Ӧ�۵Ļ�ѧ��Ӧ����ʽ_______________________________________��
��5��ҽѧ�ϳ��ú���H������Ƭ����ƶѪ�IJ��˲������ɼ����ҩƬ�Ƿ���ʵĻ�ѧ�Լ�Ϊ_________������H��˵��ҩƬ�����¿�����________���ã�
��6����A��B��MgXO4��ɵĹ��������У����XԪ�ص���������Ϊa����OԪ�ص���������Ϊ________��
���𰸡�
![]() HSO3-+H+=H2O+SO2�� 2H2S+SO2=3S��+2H2O H2S+Fe2(SO4)3=2FeSO4+S��+H2SO4 KSCN��Һ����Һ ���������������
HSO3-+H+=H2O+SO2�� 2H2S+SO2=3S��+2H2O H2S+Fe2(SO4)3=2FeSO4+S��+H2SO4 KSCN��Һ����Һ ��������������� ![]()
��������
E�����ڱ�״���µ��ܶ�Ϊ1.52g/L����E��Ħ������Ϊ![]() ��E��Fe2(SO4)3��Һ��Ӧ���ɵ�WΪԪ��X�Ĺ��嵥�ʣ����Ʋ�EΪH2S��WΪS���ʣ�XΪSԪ�أ���(5)����֪ҽѧ�ϳ��ú���H������Ƭ����ƶѪ�IJ��˲�������HΪFeSO4��Fe2(SO4)3��H2S��Ӧ����S���ʡ�FeSO4��H2SO4����GΪH2SO4��E��F�ɷ�Ӧ����S���ʣ�F��Fe2(SO4)3�ɷ�Ӧ����FeSO4��H2SO4����FΪSO2��A��B��C��Ϊ��SԪ�ص���ʽ���Σ��������ʵ�ת����ϵ�Ƴ���AΪNaHS��CΪNaHSO4��BΪNaHSO3���ݴ˷������
��E��Fe2(SO4)3��Һ��Ӧ���ɵ�WΪԪ��X�Ĺ��嵥�ʣ����Ʋ�EΪH2S��WΪS���ʣ�XΪSԪ�أ���(5)����֪ҽѧ�ϳ��ú���H������Ƭ����ƶѪ�IJ��˲�������HΪFeSO4��Fe2(SO4)3��H2S��Ӧ����S���ʡ�FeSO4��H2SO4����GΪH2SO4��E��F�ɷ�Ӧ����S���ʣ�F��Fe2(SO4)3�ɷ�Ӧ����FeSO4��H2SO4����FΪSO2��A��B��C��Ϊ��SԪ�ص���ʽ���Σ��������ʵ�ת����ϵ�Ƴ���AΪNaHS��CΪNaHSO4��BΪNaHSO3���ݴ˷������
E�����ڱ�״���µ��ܶ�Ϊ1.52g/L����E��Ħ������Ϊ![]() ��E��Fe2(SO4)3��Һ��Ӧ���ɵ�WΪԪ��X�Ĺ��嵥�ʣ����Ʋ�EΪH2S��WΪS���ʣ�XΪSԪ�أ���(5)����֪ҽѧ�ϳ��ú���H������Ƭ����ƶѪ�IJ��˲�������HΪFeSO4��Fe2(SO4)3��H2S��Ӧ����S���ʡ�FeSO4��H2SO4����GΪH2SO4��E��F�ɷ�Ӧ����S���ʣ�F��Fe2(SO4)3�ɷ�Ӧ����FeSO4��H2SO4����FΪSO2��A��B��C��Ϊ��SԪ�ص���ʽ���Σ��������ʵ�ת����ϵ�Ƴ���AΪNaHS��CΪNaHSO4��BΪNaHSO3��
��E��Fe2(SO4)3��Һ��Ӧ���ɵ�WΪԪ��X�Ĺ��嵥�ʣ����Ʋ�EΪH2S��WΪS���ʣ�XΪSԪ�أ���(5)����֪ҽѧ�ϳ��ú���H������Ƭ����ƶѪ�IJ��˲�������HΪFeSO4��Fe2(SO4)3��H2S��Ӧ����S���ʡ�FeSO4��H2SO4����GΪH2SO4��E��F�ɷ�Ӧ����S���ʣ�F��Fe2(SO4)3�ɷ�Ӧ����FeSO4��H2SO4����FΪSO2��A��B��C��Ϊ��SԪ�ص���ʽ���Σ��������ʵ�ת����ϵ�Ƴ���AΪNaHS��CΪNaHSO4��BΪNaHSO3��
(1)X��Sԭ�ӣ�Ϊ16��Ԫ�أ���ԭ�ӽṹʾ��ͼΪ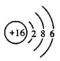 ��AΪNaHS�������ӻ������Na+��HS-���ӹ��ɣ������ʽ�ɱ�ʾΪ
��AΪNaHS�������ӻ������Na+��HS-���ӹ��ɣ������ʽ�ɱ�ʾΪ![]() ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
��![]() ��
��
(2)CΪNaHSO4��BΪNaHSO3����Ӧ�ٵ����ӷ�Ӧ����ʽΪHSO3-+H+=H2O+SO2�����ʴ�Ϊ��HSO3-+H+=H2O+SO2����
(3)EΪH2S��FΪSO2�����߷�Ӧ����S���ʺ�ˮ����Ӧ�ڵĻ�ѧ��Ӧ����ʽ2H2S+SO2=3S��+2H2O���ʴ�Ϊ��2H
(4)EΪH2S��Fe2(SO4)3��H2S��Ӧ����S���ʡ�FeSO4��H2SO4����Ӧ�۵Ļ�ѧ��Ӧ����ʽH2S+Fe2(SO4)3=2FeSO4+S��+H2SO4���ʴ�Ϊ��H2S+Fe2(SO4)3=2FeSO4+S��+H2SO4��
(5)ҽѧ�ϳ��ú�H(FeSO4)������Ƭ����ƶѪ�IJ��˲������������Ӳ��ȶ��ױ��������������ӣ��������ܺͱ��ӷ�����ɫ��Ӧ���ܺ�KSCN��Һ��Ӧ����Ѫ��ɫ��Һ�����Կ����ñ��ӻ�KSCN��Һ�����Ƿ���ʣ���H(FeSO4)��˵��ҩƬ�ϵ����¿�����ֹ�������û�������������ã��ʴ�Ϊ��KSCN��Һ����Һ�������������������
(6)��A(NaHS)��B(NaHSO3)��MgSO4��ɵĹ��������У�SԪ�ص���������Ϊa��A��B���������Ħ������Ϊ24g/mol����þ��ͬ����������ɿ���Ϊ��þԪ�ء����������С�þԪ�ء���SԪ�ص����ʵ���֮��Ϊ1:1���������С�þԪ�ء��ĵ���������Ϊ![]() ����ʣ���OԪ�ص���������Ϊ
����ʣ���OԪ�ص���������Ϊ![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��£�ij�ݻ�Ϊ2L���ܱ������ڣ�ijһ��Ӧ��M��N�����ʵ����淴Ӧʱ��仯��������ͼ��ʾ��
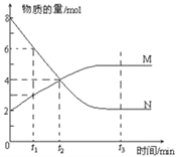
(1)�÷�Ӧ�Ļ�ѧ����ʽ��_____________________________
(2)��ͼ����ʾ������ʱ����___________(��t1��t2��t3)ʱ�̴���ƽ��״̬����ʱv��________v��(�������=)���ﵽƽ��״̬��ƽ����Ӧ����v(N)��v(M)=___________
(3)����Ӧ�������ݻ����䣬����ѹǿ���ٸı���_________(������������������)��Ϊ�÷�Ӧ�Ѵﵽƽ��״̬���ж����ݡ�
(4)��֪M��N��Ϊ���壬�����д�ʩ������Ӧ���ʵ���________(ѡ����ĸ) A�������¶� B������ѹǿ C����СM��Ũ�� D������Ӧ���������С
(5)��һ���ݻ�Ϊ4L���ܱ������г���7molSO2��4molO2����һ���¶Ⱥ�ѹǿ�£��������·�Ӧ��2SO2(g)+O22SO3(g)����4s��ﵽƽ��״̬�����SO2�����ʵ�����3mol������O2��ʾ�ķ�Ӧ����Ϊ________��ƽ��ʱSO3�����ʵ���Ũ��________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
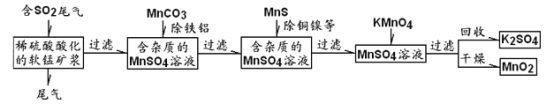
����Ŀ���ɵ�����ճ������г��õĵ�أ�ԭ��ΪZn��MnO2��ij���������̿�(��MnO2Լ70%������Al2O3)����п��(��ZnSԼ80%������FeS����)��ͬ�������������£�
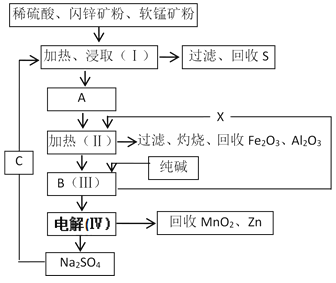
��֪����A��ZnSO4��MnSO4��Fe2(SO4)3��Al2(SO4)3�Ļ��Һ��
�ڢ��з�Ӧ�ķ���ʽΪ��MnSO4��ZnSO4��2H2O![]() MnO2��Zn��2H2SO4��
MnO2��Zn��2H2SO4��
��1�������A�У����ڻ�ԭ�������______(�ѧʽ)��
��2������X��������_____________________����֪��Һ�и����ӿ�ʼ������pH�����ʾ�������X����ҺpHӦ������_____(����ĸ)��
A��4.5 B��8.0 C��6.5 D��9.0
���� | ��ʼ����pH | ��ȫ����pH |
Fe3�� | 2.3 | 3.2 |
Al3�� | 4.2 | 5.4 |
Zn2�� | 7.2 | 8.0 |
Mn2�� | 8.3 | 9.8 |
���������ȵ�ԭ����____________________��������ΪX���벽����������Ϊ______(����ĸ)��
A��MnCO3 B��Zn2(OH)2CO3 C��NaOH D��KOH
��3�����������г���ʯ�⣬������Щԭ����Ҫ����____________(�ѧʽ)��
��4����Ҫ�Ӳ������Ĺ����еõ�â������(Na2SO4��10H2O)������Ҫ���е�ʵ�������________��________�����ˡ�ϴ�ӡ�����ȡ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ⱦ�����Чȥ������Դ�ij�������ǻ�ѧ�츣�������Ҫ�о����⡣ij��ѧ�о�С���������̿����ɷ�ΪMnO2��������������������ͭ�����Ƚ�����������������ͨ�����¼����̣����ѳ�ȼúβ���е�SO2�����Ƶõ�ز���MnO2����Ӧ��������ȥ����
��ش��������⣺
(1)������������ʵ����______________��ѡ��������ĸ��ţ���
A����������ۺ����� B����ɫ��Ⱦ�ļ��� C������ļ���
(2)��MnCO3�ܳ�ȥ��Һ��Al3����Fe3������ԭ����___________________��
(3)��֪�� 25�桢101kpaʱ��
��Mn(s)��O2(g)��MnO2(s) ��H��-520kJ/mol
��S(s)��O2(g)��SO2(g) ��H��-297kJ/mol
��Mn(s)��S(s)��2O2(g)��MnSO4(s) ��H��-1065kJ/mol
SO2��MnO2��Ӧ������ˮMnSO4���Ȼ�ѧ����ʽ��_________________��
(4)MnO2�����������������ϡ��ö��Ե缫���MnSO4��Һ���Ƶ�MnO2���������ĵ缫��Ӧʽ��______��
(5)MnO2�Ǽ���п�̵�ص��������ϡ�����п�̵�طŵ�ʱ�������ĵ缫��Ӧʽ��________��
(6)KMnO4��Һ��MnSO4��Һ��Ӧ�����ӷ�Ӧ����ʽ��________��
(7)�����ѳ���SO2ֻ�����̿��е�MnO2��Ӧ������ͼʾ���̣���a m3����״������SO2���������Ϊb%��β��ͨ�����SO2���ѳ���Ϊ89.6%�����յõ�MnO2������Ϊc kg�����ȥ��������ͭ����������ʱ�����������Ԫ���൱��MnO2_________kg��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���л���M�Ľṹ��ʽ��ͼ��ʾ�������������ӳɷ�Ӧ�õ����ʼף������й�˵������ȷ����

A.�л���M����2�ֹ�����
B.�л���M�ķ���ʽΪC4H6O2
C.�л���M�ܷ���ȡ����Ӧ���Ӿ۷�Ӧ
D.��ֻ����һ�ֹ����ŵ���״ͬ���칹�壨�����ױ�������6��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ҩ���������ͨ����ͣʹ�ú����ۺ�����������ҩƷ�Ƽ�����������(Ӣ����дΪPPA)�Ľṹ��ʽΪ��CHOHCHNH2CH3(����������������)������������һ��һȡ������ȡ�����ǡ�CHOHCHNH2CH3���������Ϣ�ش��������⣺
��1��PPA�ķ���ʽ��________��
��2������ȡ�����������������ţ�������________����________����(����д����)
��3����������H2N����HO����̼���ϵ�λ�����任������д������ͬ���칹�壬������5�ֵĽṹ��ʽ����CHOHCHNH2CH3����CHOHCH2CH2NH2����CH2CHOHCH2NH2����CHNH2CHOHCH3����CHNH2CH2CH2OH������5���⣬����______��ͬ���칹�壬��д���⼸��ͬ���칹�����еĽṹ��ʽ����Ҫ��д����OH����NH2����ͬһ��̼ԭ���ϵ��칹�壬����������ʾ��_______________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
![]()
![]() ����Ŀ��ʵ���ҽ�9g���۸�һ�����Ľ����������ĩ����γ����ȼ����������ȷ�Ӧ֮�����ù����к���������Ϊ18g������������ĩ�������� ��
����Ŀ��ʵ���ҽ�9g���۸�һ�����Ľ����������ĩ����γ����ȼ����������ȷ�Ӧ֮�����ù����к���������Ϊ18g������������ĩ�������� ��
![]()
![]() A��
A��![]() B��
B��![]() ��
��![]()
C��![]() ��
��![]() D.
D. ![]() ��FeO
��FeO
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±���Ԫ�����ڱ���һ���֣�����������ĸ�ֱ����һ��Ԫ�أ�

��1�������£��䵥�ʳ�Һ̬��Ԫ����____������ĸ���ţ�������e�γɵĻ��������ʽΪ��_____����Ԫ�ط��ű�ʾ��
bԪ���γɵĵ�������Ʒ�����Ϳ�����____������ţ�
�ٷ��Ӿ��� ��ԭ�Ӿ��� �۽������� �����Ӿ��� �ݹ����;���
��2��Ԫ��c��d��g���⻯��ķе��ɸߵ��͵�˳��Ϊ______���û�ѧʽ��ʾ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ŷš�̫���ܡ���ɫ��Դ�ȸ߿Ƽ�����2010�Ϻ�������
��1����������Χ������̬��ͣ�������к�β�������ⴥýͿ�Ϸֽ�Ϊ�����ʣ�����β���е��������������ɼ��Լ��γɵķǼ��Է��ӵ���____��
a��CO b��NO c��NO2 d��CO2
��2����һ���Ĺ����а�װ�˸����Ƚ��ܵ��մɽ�±�ƣ���±���������ͨ������NA��81Tl��49In��SC��I��Ԫ�صĵ��ʻ���й�˵����ȷ����_____��
a���ڢ�AԪ�����������һ������TlС��In
b��Ԫ��Scλ�����ڱ�s��
c���Ƶ��۵�ͣ�����Ϊ����������
d��I2����KI��Һ���ɲ���I3-���ɼ۲㻥�����ۿ���֪I3-��ֱ����
��3��������㷺�����˱�����յ���������յ�����Һ̬�������Ҷ��ͣ�HOCH2CH2OH�����ʣ��Ҷ����е�ߣ�������_____��
��4���Ϻ��������ģ����ʹ����21������ɫ��Դ��LED�뵼��������LED��Ƭ�����黯�أ�GaAs���Ȳ�����ɡ�����Gaԭ���ڻ�̬ʱ����������Ų�ʽΪ��_____��GaAs�ľ����ṹ��ͼ�������к���ԭ����Ϊ_____��

��5��������֮�������й��ݣ�����װ��7000����ɫ���壬��ɫ����Ϊ���ͷ�̼��Ϳ�Ͳģ�һ�ַ�̼Ϳ���֬��FEP�������ĵ���ΪCF3��CF=CF2���÷�����̼ԭ�ӵ��ӻ���ʽ�У�_____��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com