
(1)这3种元素的元素符号:X______________,Y______________,Z______________。
(2)X、Y形成化合物的化学键是____________________________。
(3)把X的单质放入水中,反应现象为______________,高温灼烧反应后的溶液时,火焰呈______________色。
(4)当2个Y原子间形成化学键时要______________热量。
(5)Y与Z形成的化合物的化学式为______________。实验测得,当此化合物在液态或固态时不导电,溶解于水时能导电,由此判断该化合物具有____________________________键。
科目:高中化学 来源: 题型:
| X | Y | Z | |
| I1 | 496 | 738 | 577 |
| I2 | 4562 | 1451 | 1817 |
| I3 | 6912 | 7733 | 2754 |
| I4 | 9540 | 10540 | 11578 |
查看答案和解析>>
科目:高中化学 来源:吉林省长春外国语学校2011-2012学年高二下学期期末考试化学试题 题型:022
(1)已知X、Y、Z为同一短周期的三种元素,其原子的部分电离能(kJ/mol)如下表所示:

①三种元素电负性大小关系为________.
②写出Y原子的电子排布式________Y的第一电离能大于Z的第一电离能的原因________.
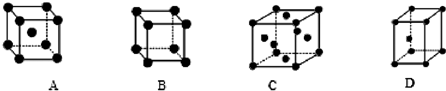
③X晶体采用下列________(填字母) 堆积方式.

(2)N2O的等电子体为:①分子________,②阴离子________;由此可知N2O的中心原子的杂化类型为________.根据价层电子对互斥模型确定NO2的分子构型为:________.
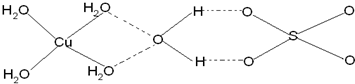
(3)已知铜能形成多种化合物,如硫酸铜的结构如下图所示,

请在图中标出水合铜离子中的配位键.
查看答案和解析>>
科目:高中化学 来源:2011-2012学年吉林省长春外国语学校高二下学期期末考试化学试卷(带解析) 题型:填空题
【物质结构与性质】(15分)
(1)已知X、Y、Z为同一短周期的三种元素,其原子的部分电离能(kJ/mol)如下表所示:
| | X | Y | Z |
| I1 | 496 | 738 | 577 |
| I2 | 4562 | 1451 | 1817 |
| I3 | 6912 | 7733 | 2754 |
| | 9540 | 10540 | 11578 |




查看答案和解析>>
科目:高中化学 来源:2013届吉林省高二下学期期末考试化学试卷(解析版) 题型:填空题
【 物质结构与性质 】(15分)
(1)已知X、Y、Z为同一短周期的三种元素,其原子的部分电离能(kJ/mol)如下表所示:
|
|
X |
Y |
Z |
|
I1 |
496 |
738 |
577 |
|
I2 |
4562 |
1451 |
1817 |
|
I3 |
6912 |
7733 |
2754 |
|
|
9540 |
10540 |
11578 |
①三种元素电负性大小关系为_______________
②写出Y原子的电子排布式_____________ Y的第一电离能大于Z的第一电离能的原因_______________________
③X晶体采用下列_________(填字母) 堆积方式。




A B C D
(2)N2O的等电子体为:①分子______________,②阴离子______________;由此可知N2O的中心原子的杂化类型为_____________。根据价层电子对互斥模型确定NO2的分子构型为:_____________________________________。
(3)已知铜能形成多种化合物,如硫酸铜的结构如下图所示,

请在图中标出水合铜离子中的配位键.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com