
【题目】下列关于烃的说法正确的是

A. 该烃分子中共面的碳原子最多为14个
B. 该烃分子中共直线的碳原子只有为4个
C. 该烃存在顺反异构
D. 1mol 该烃与溴水反应时最多可以消耗6molBr2
科目:高中化学 来源: 题型:
【题目】对于苯乙烯的下列叙述
![]()
①能使酸性KMnO4溶液褪色;②可发生加聚反应;③可溶于水;④可溶于苯中;
⑤苯环能与溴水发生取代反应;⑥所有的原子可能共面,且最多有5个原子共线。其中完全正确的是
A. ①②④B. ①②④⑥C. ①②④⑤⑥D. ①②③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2 L容积不变的容器中,发生N2+3H2 ![]() 2NH3的反应。现通入4 mol H2和4 mol N2,10 s内用H2表示的反应速率为0.12 mol/(L·s),则10 s后容器中N2的物质的量是
2NH3的反应。现通入4 mol H2和4 mol N2,10 s内用H2表示的反应速率为0.12 mol/(L·s),则10 s后容器中N2的物质的量是
A. 1.6 mol B. 2.8 mol
C. 3.2 mol D. 3.6 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重要的农药、医药中间体-碱式氯化铜[CuaClb(OH)c·xH2O],可以通过以下步骤制备。步骤 1:将铜粉加入稀盐酸中,并持续通空气反应生成 CuCl2。已知Fe3+对该反应有催化作用,其催化原理如图所示。步骤2:在制得的CuCl2溶液中,加入石 灰乳充分反应后即可制备碱式氯化铜。下列有关说法不正确的是

A.图中M、N分别为Fe2+、Fe3+
B.a、b、c 之间的关系式为:2a=b+c
C.步骤1充分反应后,加入少量CuO是为了除去Fe3+
D.若制备1 mol的CuCl2,理论上消耗标况下11.2 LO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时在2L容器中X、Y、Z三种物质的物质的量(n)随时间(t)变化的曲线如图所示,由图中数据
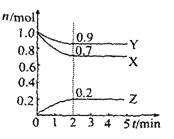
(1)该反应的化学方程式为:_____
(2)反应开始至2min,用Z表示的平均反应速率为:____
(3)下列叙述能说明上述反应达到化学平衡状态的是____(填序号)
A.混合气体的总物质的量不随时间的变化而变化
B.混合气体的压强不随时间的变化而变化
C.单位时间内每消耗3mol X,同时生成2mol Z
D.混合气体的总质量不随时间的变化而变化
(4)在密闭容器里,通入a mol X(g)和b mol Y(g),发生反应X(g) + Y(g) = 2Z(g),当改变下列条件时,反应速率会发生什么变化(选填“增大”、“减小”或“不变”)?
①降低温度:____
②加入催化剂:____
③增大容器的体积:____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1,2-二氯丙烷(CH2ClCHClCH3)是一种重要的化工原料,工业上可用丙烯加成法制备,主要副产物为3-氯丙烯(CH2=CHCH2Cl),反应原理为:
I.CH2=CHCH3(g)+Cl2(g)![]() CH2ClCHClCH3(g) H1=-134kJ·mol1
CH2ClCHClCH3(g) H1=-134kJ·mol1
II.CH2=CHCH3(g)+Cl2(g)![]() CH2=CHCH2Cl(g)+HCl(g) H2=-102kJ·mol1
CH2=CHCH2Cl(g)+HCl(g) H2=-102kJ·mol1
请回答下列问题:
(1)已知CH2=CHCH2Cl(g)+HCl(g)![]() CH2ClCHClCH3(g)的活化能Ea(正)为132kJ·mol1,则该反应的活化能Ea(逆)为___________kJ·mol1。
CH2ClCHClCH3(g)的活化能Ea(正)为132kJ·mol1,则该反应的活化能Ea(逆)为___________kJ·mol1。
(2)一定温度下,密闭容器中发生反应I和反应II,达到平衡后增大压强,CH2ClCHClCH3的产率____________(填“增大”“减小”或“不变”),理由是_____________________________。
(3)起始时向某恒容绝热容器中充入1mol CH2=CHCH3和1mol Cl2发生反应II,达到平衡时,容器内气体压强_________________(填“增大”“减小”或“不变”)。
(4)一定温度下,向恒容密闭容器中充入等物质的量的CH2=CHCH3(g)和Cl2(g)。在催化剂作用下发生反应I,容器内气体的压强随时间的变化如下表所示。
时间/min | 0 | 60 | 120 | 180 | 240 | 300 | 360 |
压强/kPa | 80 | 74.2 | 69.4 | 65.2 | 61.6 | 57.6 | 57.6 |
①用单位时间内气体分压的变化来表示反应速率,即![]() ,则前120min内平均反应速率v(CH2ClCHClCH3)=__________kPa·min1。(保留小数点后2位)。
,则前120min内平均反应速率v(CH2ClCHClCH3)=__________kPa·min1。(保留小数点后2位)。
②该温度下,若平衡时HCl的体积分数为![]() ,则丙烯的平衡总转化率
,则丙烯的平衡总转化率____________;反应I的平衡常数Kp=____________________kPa1(Kp为以分压表示的平衡常数,保留小数点后2位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物H是药物合成的种中间体,可通过以下方法合成:

(1)B中官能团名称为__。
(2)G→H的反应类型为__。
(3)已知C的一种同分异构体为: ,下列说法正确的是__。
,下列说法正确的是__。
a.能发生酯化反应
b.能发生银镜反应
c.1mol该物质完全水解能消耗3molNaOH
d.该分子的核磁共振氢谱中峰面积之比为1:2:6:2
e.其在酸性条件下的水解产物之一能与FeCl3溶液发生显色反应
(4) 中手性碳原子个数为__。
中手性碳原子个数为__。
(5)E的分子是为C14H17O3N,E经还原得到F,写出E→F的反应方程式:__。
(6)已知:①
②苯胺(![]() 易被氧化
易被氧化
请以甲苯和(CH3CO)2O为原料制备 ,写出制备的合成路线流程图(无机试剂任选)。__。
,写出制备的合成路线流程图(无机试剂任选)。__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机反应属于加成反应的是
A. C3H8 + 5O2 ![]() 3CO2 + 4H2O
3CO2 + 4H2O
B. CH2 = CH2 + Br2 → ![]()
C. 2CH3CH2OH + 2Na → 2CH3CH2ONa + H2↑
D. ![]() + HNO3
+ HNO3 ![]()
![]() + H2O
+ H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可再生的生物质资源的应用是科学家研究的重大课题。我国科学家研发了葡萄糖的各种应用。利用葡萄糖可以获得乙醇、乙二醇等基本化工原料。
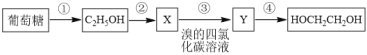
(1)C2H5OH中所含官能团的名称是_______。
(2)反应②的化学方程式为_______。
(3)反应④的化学方程式为_______。
(4)用系统命名法命名Y______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com