
某研究性学习小组的同学查阅资料得知:用无水醋酸钠与碱石灰混合加热可得到甲烷,他们欲利用右图装置(盛放排出B中饱和食盐水的装置省略了)完成氯气与甲烷的反应,请回答下列问题:
(1)A中的反应可表示为:CH3COONa+NaOH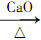 CH4+X(已配平),则X的成份是___________,装置C由两种仪器构成,它是贮气瓶(贮存有氯气),则P中贮存的物质是___________。
CH4+X(已配平),则X的成份是___________,装置C由两种仪器构成,它是贮气瓶(贮存有氯气),则P中贮存的物质是___________。
(2)实验过程中,在没有操作不当的情况下,试管底部往往也会出现裂痕,可能的原因是___________。
(3)集气瓶B是用于收集CH4、Cl2并使二者大约按照1:1的比例混合在一起,然后在光照条件下的反应。
①B内有一处需要改进,改正的方法是___________。
于判断进入B中的两种气体体积大约是1:1的方法是:___________。
(4)B中主要反应的化学方程式___________;用光可引发该反应,引发时应注意的问题是__________。
(5)确定B中的反应有HCl生成的方法是:取B中残留液与从B中排出的饱和食盐水少量相同体积分别放入X、Y两支试管中,然后__________。
科目:高中化学 来源:2016届吉林省高三第八次模拟理综化学试卷(解析版) 题型:填空题
氢能是重要的新能源。储氢作为氢能利用的关键技术,是当前关注的热点之一。
(1)氢气是清洁能源,其燃烧产物为__________。
(2)NaBH4是一种重要的储氢载体,能与水反应生成NaBO2,且反应前后B的化合价不变,该反应的化学方程式为 _,反应消耗1mol NaBH4时转移的电子数目为__________。
(3)储氢还可借助有机物,如利用环己烷和苯之间的可逆反应来实现脱氢和加氢:
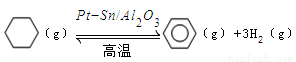 。
。
某温度下,向恒容密闭容器中加入环己烷,起始浓度为a mol/L,平衡时苯的浓度为bmol/L,该反应的平衡常数K= 。
(4)一定条件下,图示装置可实现有机物的电化学储氢(忽略其它有机物)。
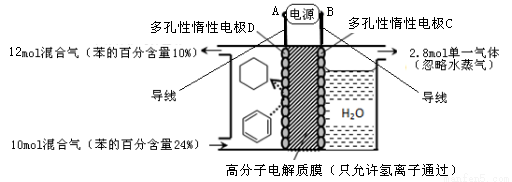
①导线中电子移动方向为 → 。(用A、B、C、D填空)
②生成目标产物的电极反应式为 。
③该储氢装置的电流效率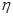 = 。(
= 。(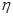 =
= ,计算结果保留小数点后1位)
,计算结果保留小数点后1位)
查看答案和解析>>
科目:高中化学 来源:2015-2016学年宁夏六盘山高中高一下期中化学试卷(解析版) 题型:选择题
下列关于同温同压下的两种气体12C18O和14N2的判断正确的是
A.体积相等时密度相等 B.原子数相等时具有的中子数相等
C.体积相等时具有的电子数相等 D.质量相等时具有的质子数相等
查看答案和解析>>
科目:高中化学 来源:2015-2016学年宁夏六盘山高中高一下期中化学试卷(解析版) 题型:选择题
下列物质性质的比较中,正确的是
A.氢化物稳定性:HBr>HCl>PH3 B.离子半径:Na+>Cl—> F-
C.碱性:NaOH>Mg(OH)2>Al(OH)3 D.离子的还原性 Cl->Br->I-
查看答案和解析>>
科目:高中化学 来源:2016届海南海南中学高三考前模拟十一化学试卷(解析版) 题型:选择题
天然海水中主要含有Na+、K+、Ca2+、Mg2+、Cl-、SO42-、Br-、CO32-、HCO3-等离子.火力发电燃煤排放的含SO2的烟气可利用海水脱硫,其工艺流程如图所示:
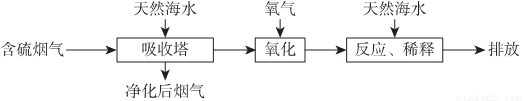
下列说法错误的是
A.天然海水pH≈8的原因是由于海水中的CO32-、HCO3-水解
B.“氧化”是利用氧气将H2SO3、HSO3-、SO32-等氧化生成SO42-
C.“反应、稀释”时加天然海水的目的是防止净化海水时生成沉淀
D.“排放”出来的海水中SO42-的物质的量浓度与进入吸收塔的天然海水相同
查看答案和解析>>
科目:高中化学 来源:2016届海南海南中学高三考前模拟十一化学试卷(解析版) 题型:选择题
短周期元素X、Y、Z的原子序数依次递增,X与Y、Z位于相邻周期,X形成的常见含氧酸能氧化氢后金属,Y、Z原子最外层电子数之比为3:7,下列说法正确的是
A.X的常见氢化物水溶液显弱碱性
B.组成为HZO的物质结构式为H—Z—O
C.最高价氧化物对应水化物酸性:Z>X>Y
D.简单离子半径:Z>Y>X
查看答案和解析>>
科目:高中化学 来源:2016届海南海南中学高三考前模拟十一化学试卷(解析版) 题型:选择题
某烃X能使溴的CCl4溶液褪色,完全燃烧时1molX需要消耗9molO2且生成等物质的量的CO2与H2O。若其结构中含有两个—CH3,则该物质的结构(不考虑立体异构)最多有
A.6种B.5种C.4种D.7种
查看答案和解析>>
科目:高中化学 来源:2015-2016学年内蒙古包头九中高一下第一次月考化学试卷(解析版) 题型:填空题
某强酸性溶液X中含有Ba2+、Al3+、NH4+、Fe2+、Fe3+、CO32-、SO32-、SO42-、Cl-、NO3- 中的一种或几种,取该溶液进行连续实验,实验过程如下:

已知:气体D在常温常压下呈现红棕色
(1)上述离子中,溶液X中除H+外还肯定含有的离子是_______,不能确定是否含有的离子(Q)是_____,若要确定该离子Q(若不止一种,可任选一种)不存在,最可靠的化学方法是_________。
(2)沉淀G的化学式为 。
(3)写出生成A的离子方程式: 。
(4)写出气体D与足量氧气反应生成E的化学方程式: 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省高一下期中化学试卷(解析版) 题型:实验题
某学习小组进行“铁与水反应所得固体物质的成分、性质及再利用”的实验探究。
【探究一】设计下图所示装置进行“铁与水反应”的实验。

(1)反应前A中投放碎瓷片的目的是____________________________________。
(2)硬质玻璃管B中发生反应的化学方程式为______________________________。
(3)装置E中的现象是________________________________________________。
【探究二】设计如下实验方案确定反应后硬质玻璃管中黑色固体的成分。
待硬质玻璃管B冷却后,取少许其中的固体物质溶于硫酸后,将所得溶液分成两份。
(4)一份滴加几滴KSCN溶液。若溶液变红色,推断硬质玻璃管B中固体物质的成分(选填序号,下同)为_______;若溶液未变红色,推断硬质玻璃管B中固体物质的成分为_______。
①只有有Fe ②只有Fe3O4 ③Fe3O4和Fe ④一定有Fe3O4,可能有Fe
(5)若要检测溶液中是否存在Fe 2+,则另一份溶液中需要加入______(填试剂)来检验
【探究三】设计如下流程测定反应后硬质玻璃管B中固体含铁元素的质量分数。

(6)计算反应后B装置中铁元素的质量分数为_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com