
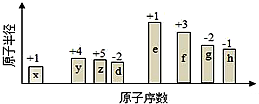
 ��ԭ�������ĵ��������ֶ�����Ԫ�أ�����ĸ��ʾ��ԭ�Ӱ뾶����Դ�С��������ۻ�����۵ı仯��ͼ��ʾ�������жϳ���Ԫ�ػش��������⣺
��ԭ�������ĵ��������ֶ�����Ԫ�أ�����ĸ��ʾ��ԭ�Ӱ뾶����Դ�С��������ۻ�����۵ı仯��ͼ��ʾ�������жϳ���Ԫ�ػش��������⣺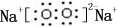 ��B�dz�����Һ̬�������ϡ��Һ�ױ����ֽ⣬��ʹ�õĴ���ΪAB��������ţ�
��B�dz�����Һ̬�������ϡ��Һ�ױ����ֽ⣬��ʹ�õĴ���ΪAB��������ţ�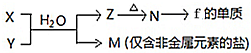
���� ��ͼ�еĻ��ϼۺ�ԭ�Ӱ뾶�Ĵ�С����֪x��HԪ�أ�y��CԪ�أ�z��NԪ�أ�d��OԪ�أ�e��NaԪ�أ�f��AlԪ�أ�g��SԪ�أ�h��ClԪ�أ�
��1��f��AlԪ�أ���Ԫ�����ڱ���λ���ǵ������ڢ�A�壻
��2���ǽ�����Խǿ�����������ˮ���������Խǿ��
��3���ɱ�������Ԫ�ص�ԭ�Ӱ�1��1��ɵĻ�����A��B��A�мȺ����Ӽ��ֺ��Ǽ��Թ��ۼ�����AΪNa2O2��B�dz�����Һ̬�������ϡ��Һ�ױ����ֽ⣬��BΪH2O2���ݴ˴��⣻
��4��f��AlԪ�أ���NΪAl2O3��ZΪAl��OH��3��MΪ�����ǽ���Ԫ�ص��Σ�ӦΪ��Σ���ӦX+YӦ�ǰ�����������ˮ��Һ�еķ�Ӧ��������Һ�ĵ������ж���Һ������ԣ�
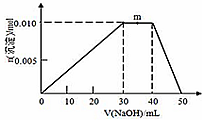
��5����m������м����������ƣ��������ʵ������䣬��NH4+��OH-��Ӧ����NH3•H2O��
�ڸ���n=cV����n��Al3+ ����n��NH4+����n��SO42-����n��Ba2+����n��OH-��������SO42-��Ba2+�в����������ӵ����ʵ�����������BaSO4�����ʵ��������η�����Al3++OH-=Al��OH��3����NH4++OH-=NH3•H2O��Al��OH��3+OH-=AlO2-+2H2O�����ݷ���ʽ��������Al��OH��3�����ʵ������������������ɹ��������ʵ�����
��� �⣺��ͼ�еĻ��ϼۺ�ԭ�Ӱ뾶�Ĵ�С����֪x��HԪ�أ�y��CԪ�أ�z��NԪ�أ�d��OԪ�أ�e��NaԪ�أ�f��AlԪ�أ�g��SԪ�أ�h��ClԪ�أ�
��1��f��AlԪ�أ���Ԫ�����ڱ���λ���ǵ������ڢ�A�壬
�ʴ�Ϊ���������ڢ�A�壻
��2���ǽ�����Խǿ�����������ˮ���������Խǿ�������ԣ�HClO4��H2SO4��H2CO3��
�ʴ�Ϊ��HClO4��H2SO4��H2CO3��
��3���ɱ�������Ԫ�ص�ԭ�Ӱ�1��1��ɵĻ�����A��B��A�мȺ����Ӽ��ֺ��Ǽ��Թ��ۼ�����AΪNa2O2�������ʽΪ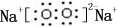 ��B�dz�����Һ̬�������ϡ��Һ�ױ����ֽ⣬��BΪH2O2����ʹ˫��ˮ��Ĵ���ΪMnO2��FeCl3����ѡAB��
��B�dz�����Һ̬�������ϡ��Һ�ױ����ֽ⣬��BΪH2O2����ʹ˫��ˮ��Ĵ���ΪMnO2��FeCl3����ѡAB��
�ʴ�Ϊ��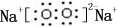 ��AB��
��AB��
��4������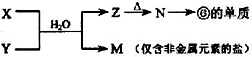 ��Ӧת����֪��fΪAlԪ�أ���NΪAl2O3��ZΪAl��OH��3��MΪ�����ǽ���Ԫ�ص��Σ�ӦΪ��Σ���ӦX+YӦ�ǰ�����������ˮ��Һ�еķ�Ӧ��X��Һ��Y��Һ��Ӧ�����ӷ���ʽΪAl3++3NH3•H2O=Al��OH��3��+3NH4+��
��Ӧת����֪��fΪAlԪ�أ���NΪAl2O3��ZΪAl��OH��3��MΪ�����ǽ���Ԫ�ص��Σ�ӦΪ��Σ���ӦX+YӦ�ǰ�����������ˮ��Һ�еķ�Ӧ��X��Һ��Y��Һ��Ӧ�����ӷ���ʽΪAl3++3NH3•H2O=Al��OH��3��+3NH4+��
�ʴ�Ϊ��Al3++3NH3•H2O=Al��OH��3��+3NH4+��
��M��Һ��笠�����ˮ������ԣ�Ҫʹ0.1mol/L M ��Һ����M���������������Ũ����ȣ�������Һ�ĵ����Կ�֪c��H+��=c��OH-��������Ӧ����Һ�м���һ������Y��Һ����Һ�����ԣ�
�ʴ�Ϊ����Һ�����ԣ�
��5����m������м����������ƣ��������ʵ������䣬��NH4+��OH-��Ӧ����NH3•H2O�����ӷ���ʽΪ��NH4++OH-=NH3•H2O��
�ʴ�Ϊ��NH4++OH-=NH3•H2O��
��10mL 1mol•L-1 NH4Al��SO4��2��Һ��Al3+ ���ʵ���Ϊ0.01mol��NH4+�����ʵ���Ϊ0.01mol��SO42-�����ʵ���Ϊ0.02mol��20mL 1.2 mol•L-1Ba��OH��2��Һ��Ba2+���ʵ���Ϊ0.024mol��OH-Ϊ0.048mol��
��SO42-+Ba2+=BaSO4������֪SO42-���㣬�ʿ��Եõ�0.02mol BaSO4��
Al3++3OH-=Al��OH��3��
0.01mol 0.03mol 0.01mol
��Ӧʣ��OH-Ϊ0.048mol-0.03mol=0.018mol��
NH4++OH-=NH3•H2O
0.01mol 0.01mol
��Ӧʣ��OH-Ϊ0.018mol-0.01mol=0.008mol��
Al��OH��3+OH-=AlO2-+2H2O
0.008mol 0.008mol
�ʵõ�Al��OH��3����Ϊ0.01mol-0.008mol=0.002mol
�����յõ�����Ϊ0.02mol+0.002mol=0.022mol��
�ʴ�Ϊ��0.022��
���� ���⿼��ṹλ�����ʹ�ϵ��Ԫ�������ɡ�����ʽ�����ӷ�Ӧ����ʽ����ѧͼ��ѧ���㣬�Ƕ�ѧ���ۺ������Ŀ��飬��Ҫѧ���߱���ʵ�Ļ������Ѷ��еȣ�


 �߲������Ӧ��һ��ͨϵ�д�
�߲������Ӧ��һ��ͨϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 24g | B�� | 18g | C�� | 21.6g | D�� | 25.2g |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �٢ڢۢܢ� | B�� | �٢ܢ� | C�� | �ۢܢ� | D�� | �ۢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | BaSO4��s��?Ba2+��aq��+SO42-��aq�� | B�� | HClO=H++ClO- | ||
| C�� | NaHSO3=Na++H++SO32- | D�� | H2S+H2O?H3O++HS- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���³�ѹ�£�1.56g Na2O2���е���������Ϊ0.02NA | |
| B�� | ��״���£�22.4L SO3���еķ�����ΪNA | |
| C�� | 0.1mol�������뷴Ӧ��ת�Ƶĵ�����һ��Ϊ0.2NA | |
| D�� | ���ʵ���Ũ��Ϊ0.5 mol/L��MgCl2��Һ�У�����Cl������ΪNA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��pH��ֽ��˫��ˮ��pH | |
| B�� | ����ʽ�ζ�����ȡ20.00 mL����K2Cr2O7��Һ | |
| C�� | ��������ƽ��ȡ 5.85 g NaCl���� | |
| D�� | �ô�ĥ�ڲ��������Լ�ƿ����Na2CO3��Һ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ͬ��ͬѹ�£�H2 ��g��+Cl2��g���T2HCl��g���ڹ��պ͵�ȼ�����µġ�H����ͬ | |
| B�� | ��pH��ֽ�ⶨ������ˮ��pH | |
| C�� | ��֪����2H2��g��+O2��g���T2H2O ��g����H1 ��2H2��g��+O2 ��g���T2H2O��1����H2�����H1����H2 | |
| D�� | ���к͵ζ�ʵ���У��ô���NaOH��Һ��ϴ��ƿ���ⶨ�����ƫ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��Cl2ͨ��H2O�У�Cl2+H2O�T2H++Cl-+ClO- | |
| B�� | NaOH��Һ�м���Al�ۣ�2Al+4OH-�T2AlO2-+2H2O | |
| C�� | �Ȼ�������Һ�м���������ˮ��Cl2+Fe2+�TFe3++2Cl- | |
| D�� | NaHCO3��Һ������ķ�Ӧ��HCO3-+H+�TCO2��+H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ������ӵ�����������2�֣�
������ӵ�����������2�֣� ���Ƚ�Na2O��Na2S���۵�ߵͣ�Na2O��Na2S��
���Ƚ�Na2O��Na2S���۵�ߵͣ�Na2O��Na2S���鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com