
【题目】有A、B、C、D四种元素,A元素的原子有三个电子层,最外层上有一个电子;B元素负2价阴离子的电子层结构与氩原子相同;C元素的原子核内无中子;D原子核外电子数比A原子核外电子总数多6个。
(1)C与D形成化合物的化学式_______,其在水中的电离方程式为_______________。
(2)B离子的结构示意图_____________________。
(3)D元素在周期表中的位置_____________________。
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】实验室需要0.1mol·L-1NaOH溶液450mL和0.5mol·L-1硫酸溶液500mL。根据这两种溶液的配制情况回答下列问题:
(1)如图所示的仪器中配制溶液肯定不需要的是__________(填序号),配制上述溶液还需用到的玻璃仪器是__________(填仪器名称)。
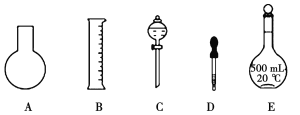
(2)配制0.1mol·L-1NaOH溶液操作步骤如下:
①把称量好的NaOH`固体放入小烧杯中,加适量蒸馏水溶解;
②把①所得溶液冷却至室温,再小心转入一定容积的容量瓶中;
③继续向容量瓶中加蒸馏水至液面距刻度线1~2cm处,改用胶头滴管小心滴加蒸馏水至溶液凹液面与刻度线相切;
④用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤的液体都小心转入容量瓶,并轻轻摇匀;
⑤将容量瓶瓶塞塞紧,充分摇匀。
操作步骤的正确顺序为__________(填序号)。
(3)根据计算用托盘天平称取NaOH的质量为__________g。在实验中其他操作均正确,若容量瓶用蒸馏水洗涤后未干燥,则所得溶液浓度______________0.10mol·L-1(填“大于”“等于”或“小于”,下同)。若还未等溶液冷却就定容了,则所得溶液浓度__________0.10mol·L-1。
(4)根据计算得知,所需质量分数为98%、密度为1.84g·cm-3的浓硫酸的体积为__________mL(计算结果保留一位小数)。如果实验室有10mL、15mL、20mL、50mL的量筒,应选用__________mL的量筒最好。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁一空气电池是一种能被水激活的一次性储备电池,原理如图所示。下列说法错误的是

A. 放电时,外电路电子由镁电极流向多孔碳材料电极
B. 放电时,正极的电极反应式为O2+ 4e—+ 2H2O =4OH
C. 理论上,外电路中流过2 mol电子时,负极质量增加58 g
D. 电池反应产物Mg(OH)2经过灼烧与还原可制成镁锭循环利用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为研究沉淀的生成及其转化,某小组进行如图实验。关于该实验的分析不正确的是
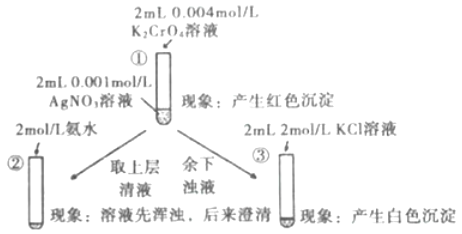
A.①浊液中存在平衡:Ag2CrO4(s)2Ag+(aq)+CrO42-(aq)
B.②中溶液变澄清的原因:AgOH+2NH3·H2O=[Ag(NH3)2]OH+2H2O
C.③中颜色变化说明有AgCl生成
D.该实验可以证明AgCl比Ag2CrO4更难溶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学课外活动小组拟用铅蓄电池进行电絮凝净水的实验探究,设计的实验装置示意图如下。下列叙述正确的是
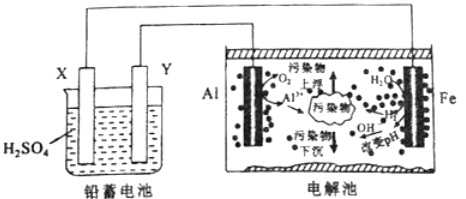
A.Y的电极反应为:Pb-2e-+SO42-=PbSO4
B.电解池内仅发生反应:2Al+6H2O=2Al(OH)3↓+3H2↑
C.若电解池阴极上有0.5mol H2生成,则铅蓄电池中消耗H2SO4为98g
D.用电絮凝法净化过的水,pH显著升高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种通过铁基氧载体(Fe3O4/FeO)深度还原和再生来合成二甲醚(CH3OCH3) 的原理如图:
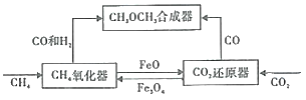
(1)二甲酸的合成反应:3CO(g)+3H2(g)=CH3OCH3(g)+CO2(g);△H1
①已知CO、CH3OCH3与H2的燃烧热(△H)分别为 a kJ/mol、b kJ/mol、c kJ/mol(a、b、c均小于0),则△H1 ____kJ/moL。
②该反应选用(CuO/ZnO/Al2O)复合催化剂,该催化剂能_____(填标号)。
A.提高反应速率 B.促进平衡正向移动 C.改变反应的焓变 D.降低反应的活化能
(2)CH4氧化器中发生的主反应:
i.CH4(g)+Fe3O4(s)=CO(g)+2H2(g)+3FeO(s)
ii.CH4(g)+4Fe3O4(s)=CO2(g)+2H2O(g)+12FeO(s)
850℃时,压强和部分气体体积分数、固相各组分质量分数的关系如图。
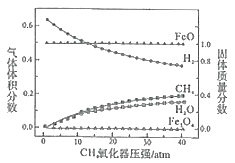
①随着压强的增大,反应i的平衡常数K值________(填“增大”、“减小”或“不变”)。
②结合图像,分析H2O的体积分数变化的原因________(用化学方程式表示)。
(3)将一定量的FeO 和CO2置于CO2还原器(体积不变的密闭容器)中,发生的主反应:CO2(g)+3FeO(s)=Fe3O4(s)+CO(g)。保持其他条件不变,测得不同温度下最终反应体系中CO、CO2体积分数如下表。
温度t/℃ | 100 | 170 | 200 | 300 | 400 | 500 |
CO2体积分数 | 0.67 | 0.67 | 0.75 | 0.82 | 0.9 | 0.92 |
CO体积分数 | 0.33 | 0.33 | 0.25 | 0.18 | 0.1 | 0.08 |
①△H2______0(填“>”或“<”)。
②由上表可知,若在150℃时进行上述转化,理论转化率α(FeO)为100%。在上述反应体系中,一定可以说明该反应达到平衡状态的是______(填标号)。
A.CO2的物质的量不变
B.体系的压强不变
C.气体的平均摩尔质量不变
D.CO的生成速率和消耗速率相等且不等于零
③根据化学反应原理,分析CO2还原器温度设置在170℃的原因________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋植物如海带、海藻中含有丰富的碘元素,主要以碘化物形式存在。有一化学课外小组用海带为原料制取少量碘单质,他们将海带灼烧成灰,用水浸泡一段时间(让碘化物充分溶解在水中),得到海带灰悬浊液,然后按以下实验流程提取单质碘:
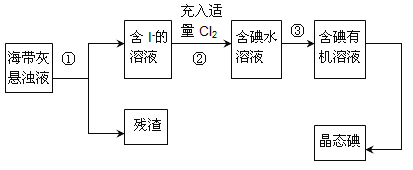
(1)指出提取碘的过程中有关的实验操作名称:①________,③________;
(2)操作③中所用的有机试剂可以是________;
A.乙醇 B.四氯化碳 C.乙酸 D.汽油
(3)已知操作步骤②中得到的“含碘水溶液中有Cl-离子存在,写出该步骤的离子反应:___________________________________________;
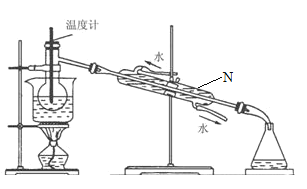
(4)从含碘的有机溶液中提取碘和回收有机溶液,还需要经过蒸馏,观察如图所示实验装置,指出仪器N的名称是:________________________,装置中有典型两处错误,加以改正:①________________________,②_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液的说法正确的是
A.常温下,0.1 mol/L Na2S溶液中存在:c(OH﹣)=c(H+)+c(HS﹣)+c(H2S)
B.0.1mol/L NaHCO3溶液与0.1mol/L NaOH溶液等体积混合,所得溶液中:C(Na+)>c(CO32-)>c(HCO3- )>c(OH-) >c(H+)
C.pH相同的①CH3COONa②NaHCO3③NaClO三种溶液的c(Na+):①>②>③
D.向0.1 mol·L-1的氨水中加入少量硫酸铵固体,则溶液中c(OH﹣)/c(NH3·H2O)增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示有关物质之间的转化关系,其中A为常见的金属单质,B为非金属单质(一般是黑色粉末),C是常见的无色无味液体,D是淡黄色的固体化合物(反应条件图中已省略)
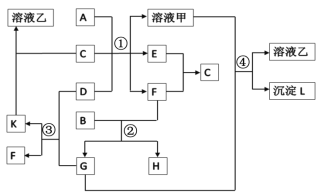
(1)A,D代表的物质分别为:________,________(填化学式);
(2)反应①中的C,D均过量,该反应的化学方程式是____________________________________;
(3)反应②中,若B与F物质的量之比为4∶3,G,H分别是_______,_______(填化学式);其物质的量之比为__________.
(4)反应③产物中K的化学式为____________;④的离子方程式为_____________________________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com