
(14分)某种锂离子电池的正极材料是将含有钴酸锂(LiCoO2)的正极粉均匀涂覆在铝箔上制成的,可以再生利用。某校研究小组尝试回收废旧正极材料中的钴。
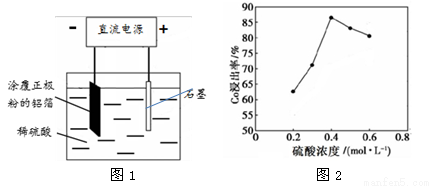
(1)25℃时,用图1所示装置进行电解,有一定量的钴以Co2+的形式从正极粉中浸出,且两极均有气泡产生,一段时间后正极粉与铝箔剥离。
①阴极的电极反应式为:LiCoO2 + 4H+ + e- === Li+ + Co2+ + 2H2O 、 。
阳极的电极反应式为 。
②该研究小组发现硫酸浓度对钴的浸出率有较大影响,一定条件下,测得其变化曲线如图2所示。当c(H2SO4) > 0.4 mol·L-1时,钴的浸出率下降,其原因可能为 。
(2)电解完成后得到含Co2+的浸出液,且有少量正极粉沉积在电解槽底部。用以下步骤继续回收钴。
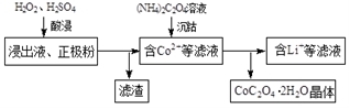
①写出“酸浸”过程中正极粉发生反应的化学方程式 。该步骤一般在80℃以下进行,温度不能太高的原因是 。
②已知(NH4)2C2O4溶液呈弱酸性,下列关系中正确的是 (填字母序号)。
a.c (NH4+)> c(C2O42-)>c (H+)>c (OH-)
b.c (H+) +c (NH4+) =c (OH-) + c(HC2O4-)+c(C2O42-)
c.c (NH4+)+ c (NH3H2O ) = 2[c(C2O42-) + c(HC2O4-) + c(H2C2O4)]
(3)已知所用锂离子电池的正极材料为x g,其中LiCoO2(M = 98 g·mol-1)的质量分数为a%,则回收后得到CoC2O42H2O (M = 183 g·mol-1)的质量不高于 g。
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2014-2015陕西省宝鸡市高一4月月考化学试卷(解析版) 题型:实验题
(8分)实验探究是体验知识的产生和形成过程的基本途径。下面是某同学完成的探究实验报告的一部分:
实验名称:卤素单质的氧化性强弱比较
实验步骤 | 实验结论 |
①氯水+1 mL CCl4,振荡,静置,观察四氯化碳层颜色 | 氧化性从强到弱的顺序:氯、溴、碘 |
②NaBr溶液+氯水+1 mL CCl4,振荡,静置,观察四氯化碳层颜色 | |
③KI溶液+氯水+1 mL CCl4,振荡,静置,观察四氯化碳层颜色 |
实验药品:KBr溶液、KI溶液、氯水、溴水、碘水、四氯化碳、淀粉碘化钾试纸
实验设计如下,请回答:
(1)完成该实验需用到的实验仪器是________、________。
(2)②中反应的化学方程式为________________。
③中反应的离子方程式为__________________。
(3)CCl4在实验中所起的作用是________。
(4)该同学的实验设计不足之处是___________________,改进的办法是____________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东湛江高三第二次模拟考试理综化学试卷(解析版) 题型:选择题
下列陈述Ⅰ、Ⅱ正确并且有因果关系的是
选项 | 陈述Ⅰ | 陈述Ⅱ |
A | SO3溶于水后能导电 | SO3为电解质 |
B | 铁比铜活泼 | 铜板上的铁钉在潮湿空气中容易生锈 |
C | 浓H2SO4有强氧化性 | 浓H2SO4常温下能与Cu发生反应 |
D | 小苏打可做焙制糕点的膨松剂 | NaHCO3能与碱反应 |
查看答案和解析>>
科目:高中化学 来源:2014-2015学年北京市西城区高三二模理综化学试卷(解析版) 题型:实验题
(15分)某小组同学利用铝和氧化铁发生铝热反应后得到的固体进行如下实验。
(1)铝和氧化铁反应的化学方程式是 。
(2)固体成分的初步确定。
实验序号 | 操作及现象 |
ⅰ | 取少量固体样品,加入过量稀盐酸,固体溶解,产生无色气体(经检验为H2),溶液呈浅黄色 |
ⅱ | 向ⅰ中所得溶液中加入少量KSCN溶液,溶液呈浅红色,再加入H2O2溶液至过量,产生无色气体(经检验为O2),溶液变为深红色,且红色很快褪去 |
①由上述实验可知:溶液中Fe元素的存在形式有 。
②ⅰ中产生H2的原因是样品中除含Fe外,可能有未反应的Al,为检验样品中是否含Al单质,设计了相关实验,依据的原理是(用离子方程式表示) 。
③生成O2的化学方程式是 。
进一步的实验表明,上述固体样品中Fe元素的存在形式有:Fe、Fe2O3、Fe3O4。
(3)该小组同学对ⅱ中溶液红色褪去的原因做进一步探究。
实验序号 | 操作、现象 |
ⅲ | 将ⅱ中剩余溶液均分为两份,一份滴加NaOH溶液,产生红褐色沉淀; 另一份滴加BaCl2溶液,产生白色沉淀,加入盐酸,沉淀不溶解 |
ⅳ | 取2 mL 0.1 mol/L FeCl3溶液,滴入KSCN溶液,溶液变为红色,通入一段时间O2,无明显变化。再加入H2O2溶液,红色很快褪去 |
提示:KSCN中S元素的化合价为-2价
①实验ⅲ中白色沉淀的化学式是 。
②结合实验ⅲ和ⅳ分析,实验ⅱ中红色褪去的原因是 。
③查阅资料得知:Cl-对溶液红色褪去的反应有催化作用,验证该说法应补充的实验和现象是 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年北京市西城区高三二模理综化学试卷(解析版) 题型:选择题
下列说法不正确的是
A.为除去FeSO4溶液中的Fe2(SO4)3,可加入铁粉,再过滤
B.为除去溴苯中的溴,可用NaOH溶液洗涤,再分液
C.为除去乙炔气中少量的H2S,可使其通过CuSO4溶液
D.为除去CO2中少量的SO2,可使其通过饱和Na2CO3溶液
查看答案和解析>>
科目:高中化学 来源:2014-2015学年北京市海淀区高三第二学期期末练习理综化学试卷(解析版) 题型:选择题
已知16S和34Se位于同一主族,下列说法正确的是
A.热稳定性:H2Se>H2S>H2O B.原子半径:Se>S>Cl
C.酸性:H2SeO4>H2SO4>HClO4 D.还原性:S2-> Se2- >Br-
查看答案和解析>>
科目:高中化学 来源:2014-2015学年北京市海淀区高三4月模拟练习化学试卷(解析版) 题型:实验题
为检验淀粉水解的情况,进行如下图所示的实验,试管甲和丙均用60~80℃的水浴加热5~6 min,试管乙不加热。待试管甲中的溶液冷却后再进行后续实验。

实验1:取少量甲中溶液,加入新制氢氧化铜,加热,没有砖红色沉淀出现。
实验2:取少量乙中溶液,滴加几滴碘水,溶液变为蓝色,但取少量甲中溶液做此实验时,溶液不变蓝色。
实验3:取少量丙中溶液加入NaOH溶液调节至碱性,再滴加碘水,溶液颜色无明显变化。
(1)写出淀粉水解的化学方程式: 。
(2)设计甲和乙是为了探究 对淀粉水解的影响,设计甲和丙是为了探究 对淀粉水解的影响。
(3)实验1失败的原因是 。
(4)实验3中溶液的颜色无明显变化的原因是 。
(5)下列结论合理的是 (填字母)。
a.淀粉水解需要在催化剂和一定温度下进行
b.欲检验淀粉是否完全水解,最好在冷却后的水解液中直接加碘
c.欲检验淀粉的水解产物具有还原性,应先在水解液中加入氢氧化钠中和稀硫酸至溶液呈碱性,再加入新制氢氧化铜并加热
d.若用唾液代替稀硫酸,则实验1可能出现预期的现象
查看答案和解析>>
科目:高中化学 来源:2014-2015学年北京市丰台区高三第二次模拟理综化学试卷(解析版) 题型:选择题
下列说法正确的是
A.用核磁共振氢谱图可以鉴别乙醇和溴乙烷
B.乙烯、苯、乙醇均能使酸性高锰酸钾溶液褪色
C.乙醇可以转化成乙醛,乙醇和乙醛都能发生加成反应
D. 的结构中只含有羟基和羧基
的结构中只含有羟基和羧基
查看答案和解析>>
科目:高中化学 来源:2014-2015浙江省高二4月月考化学试卷(解析版) 题型:选择题
下列关于乙二醇和丙三醇的说法中,不正确的是
A.乙二醇的水溶液凝固点很低,可作汽车发动机的抗冻剂
B.丙三醇的沸点比乙二醇的沸点高,可用于配制化妆品
C.这两种多元醇都易溶于水,但难溶于有机溶剂
D.丙三醇可以制造炸药,乙二醇是制涤纶的主要原料
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com