
| A、用明矾净化饮用水 |
| B、清晨林间透过缕缕阳光 |
| C、三氯化铁溶液中加入NaOH出现红褐色沉淀 |
| D、向煮熟的豆浆中加入石膏或卤水以生产豆腐 |


 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:
 有A、B、C、D、F、G六种短周期主族元素,它们的原子序数依次增大.B元素的最高正价与最低负价的绝对值相等,D元素原子最外层电子数是次外层电子数的3倍,F元素在地壳中含量居第二位;A与B、C、D分别构成电子数相等的分子Q、X、Y;化合物AG在空气中与X反应产生白烟Z.
有A、B、C、D、F、G六种短周期主族元素,它们的原子序数依次增大.B元素的最高正价与最低负价的绝对值相等,D元素原子最外层电子数是次外层电子数的3倍,F元素在地壳中含量居第二位;A与B、C、D分别构成电子数相等的分子Q、X、Y;化合物AG在空气中与X反应产生白烟Z.查看答案和解析>>
科目:高中化学 来源: 题型:
 如图是现今常规生产发烟硫酸和硫酸的流程图:
如图是现今常规生产发烟硫酸和硫酸的流程图:查看答案和解析>>
科目:高中化学 来源: 题型:
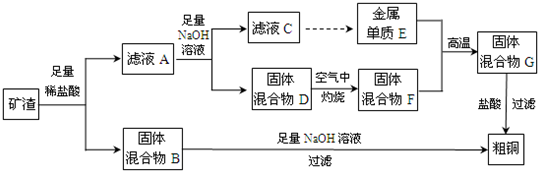
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
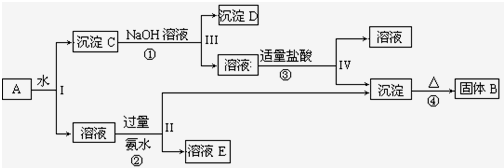
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、12C的相对原子质量为12g?mol-1 |
| B、MgCl2的摩尔质量是95 g |
| C、0.5 mol氢元素约含6.02×1023个氢原子 |
| D、NA常数约为6.02×1023 mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com