
【题目】(1)一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:
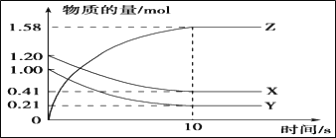
①反应开始到平衡,用Z表示的反应速率为_____________mol·L-1·s-1。
②Y的转化率为_________________。
③该反应的化学方程式为_____________________________________________。
(2)利用铜棒、锌片和200ml稀硫酸组成原电池,将化学能转化为电能,当铜棒上共产生3.36L(标准状况)气体时,硫酸恰好全部被消耗。请回答下列问题:
①该原电池的正极反应式为:_________________________________。
②计算原稀硫酸的物质的量浓度为___________________。
③若将铜棒换成铁片,仍按题给方式组合起来,能否组成原电池呢?_______(填“能”或“不能”) 若能组成原电池,此原电池的负极反应式是______________。
【答案】 0.079 79% X + Y ![]() 2Z 2H+ + 2e-=H2↑ 0.75mol/L 能 Zn - 2e-=Zn2+
2Z 2H+ + 2e-=H2↑ 0.75mol/L 能 Zn - 2e-=Zn2+
【解析】(1)①根据图像可知X和Y的物质的量减少,是反应物,Z的物质的量增加,是生成物,10s时反应达到平衡状态,消耗X是1.20mol-0.41mol=0.79mol,消耗Y是1.00mol-0.21mol=0.79mol,生成Z是1.58mol,根据变化量之比是相应的化学计量数之比可知该反应的化学方程式为X + Y![]() 2Z。反应开始到平衡,用Z表示的反应速率为
2Z。反应开始到平衡,用Z表示的反应速率为![]() =0.079mol·L-1·s-1。②Y的转化率为0.79mol/1.00mol×100%=79%。③根据以上分析可知该反应的化学方程式为X + Y
=0.079mol·L-1·s-1。②Y的转化率为0.79mol/1.00mol×100%=79%。③根据以上分析可知该反应的化学方程式为X + Y![]() 2Z。
2Z。
(2)①锌比铜活泼,锌是负极,铜是正极,溶液中氢离子放电,则该原电池的正极反应式为2H+ + 2e-=H2↑。②3.36L气体是氢气,物质的量是3.36L÷22.4L/mol=0.15mol,根据氢原子守恒可知硫酸的物质的量是0.15mol,所以原稀硫酸的物质的量浓度为0.15mol÷0.2L=0.75mol/L。③锌比铁活泼,若将铜棒换成铁片,仍按题给方式组合起来,仍然能够组成原电池,其中负极是仍然是锌,负极反应式是Zn-2e-=Zn2+。
电极:掌握原电池的工作原理是解答的关键,即原电池中较活泼的金属是负极,失去电子,发生氧化反应。电子经导线传递到正极,所以溶液中的阳离子向正极移动,正极得到电子,发生还原反应。


 寒假学与练系列答案
寒假学与练系列答案科目:高中化学 来源: 题型:
【题目】海水提溴过程中,将溴吹入吸收塔,使溴蒸气和吸收剂SO2发生作用以达到富集的目的,化学反应为Br2+SO2+2H2O=2HBr+H2SO4,下列说法正确的是
A.Br2在反应中表现氧化性 B.SO2在反应中被还原
C.Br2在反应中失去电子 D.1 mol氧化剂在反应中得到1 mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是 ( )
A. 煤的干馏可以得到苯、甲苯等芳香烃
B. 防腐剂福尔马林(含HCHO)可用作食品保鲜剂
C. “乙醇汽油”是在汽油中加入乙醇生成的一种新化合物
D. 风化、潮解、煤的气化、煤的液化和石油分馏等都是物理变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】易混易错题组
Ⅰ、官能团能体现有机物的特殊性质,认识下列有机物的官能团。
(1)C6H5CH2OH的物质类别是______
(2)非诺洛芬 中的官能团的结构简式是__________
中的官能团的结构简式是__________
(3)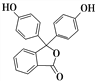 中含氧官能团的名称是______________
中含氧官能团的名称是______________
Ⅱ、按要求回答关于有机物命名的问题:
(1)
该烃主链碳原子数为_______,支链数为________,
学法题:
①烷烃选择主链的要求是____________________。
② 该烃的主链碳原子数为______,
该烃的主链碳原子数为______,
学法题:
(1)烯烃或二烯烃选择主链的要求是_______________。
(2)写出(CH3CH2)2C(CH3)2的系统命名___________________
(3)分子式为C6H12的某烯烃,所有的碳原子都在同一平面上,写出其结构简式:_______________,其系统命名是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,参照元素①~⑧在表中的位置,请回答下列问题。
周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
一 | ① | |||||||
二 | ② | ③ | ||||||
三 | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
(1)画出⑤的离子结构示意图______。
(2)③、④、⑧的原子中半径最大的是_______(写编号)。
(3)④和⑥的最高价的氧化物的水化物中碱性强的是______。
②和⑦的气态氢化物中的稳定性强的是______(均填化学式)。
(4)写出一种由①②组成且含有非极性键的物质的电子式_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于氧化还原反应的叙述,正确的是
A.有一种元素得电子,肯定有另一种元素失电子
B.在反应中不一定所有元素的化合价都发生变化
C.某元素由化合态变为游离态,则该元素一定得电子
D.氧化还原反应中不一定有电子的转移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列说法正确的是
A. 11.2 L氧气中所含有的原子数为NA
B. 7.8g的Na2O2中含有的阴离子的数目为0.2NA
C. 0.10 mol Fe 粉与足量水蒸气反应生成的H2分子数为0.10 NA
D. 54 g Al分别与足量的稀硫酸及氢氧化钠溶液反应失去的电子数都是6NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com