
常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如表
请回答:
(1)从①组情况分析,HA是________(填“强酸”或“弱酸”)。
(2)②组情况表明,c________0.2mol/L(选填“大于”、“小于”或“等于”)。混合溶液中离子浓度c(A-)与c(Na+)的大小关系________________________。
(3)从③ 组实验结果分析,说明HA的电离程度________NaA的水解程度(选填“大于”、“小于”或“等于”),该混合溶液中离子浓度由大到小的顺序是_______________________________。
科目:高中化学 来源: 题型:
下列反应的离子方程式书写正确的是( )
A.等体积等物质的量浓度的氢氧化钡溶液与碳酸氢铵溶液混合:Ba2++2OH-+NH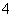 +HCO
+HCO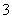 ===BaCO3↓+NH3·H2O+H2O
===BaCO3↓+NH3·H2O+H2O
B.实验室配制的亚铁盐溶液在空气中被氧化:4Fe2++O2+2H2O===4Fe3++4OH-
C.向碳酸氢铵溶液中加过量石灰水并加热:NH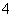 +OH-
+OH-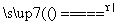 NH3↑+H2O
NH3↑+H2O
D.用酸化的高锰酸钾溶液氧化双氧水:2MnO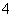 +6H++H2O2===2Mn2++3O2↑+4H2O
+6H++H2O2===2Mn2++3O2↑+4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
20℃时,H2S的饱和溶液1 L,浓度约0.1 mol·L-1,其电离方程式为:第一步:H2S
 H++HS-;第二步:HS-
H++HS-;第二步:HS-
 H++S2-,若使溶液中H+、S2-浓度同时减小,可采取的措施是( )
H++S2-,若使溶液中H+、S2-浓度同时减小,可采取的措施是( )
①加入适量NaOH固体 ②加入适量水 ③通入适量SO2 ④加入适量CuSO4固体
A.①④ B.②④ C.②③ D.①③
查看答案和解析>>
科目:高中化学 来源: 题型:
有关①100 mL 0.1 mol/L NaHCO3、②100 mL 0.1 mol/L Na2CO3两种溶液的叙述不正确的是( )
A.溶液中水电离出的OH—个数:②>① B.溶液中阴离子的物质的量浓度之和:②>①
C.①溶液中:c(CO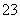 )>c(H2CO3) D.②溶液中:c(HCO
)>c(H2CO3) D.②溶液中:c(HCO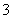 )>c(H2CO3)
)>c(H2CO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
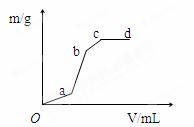
向用盐酸酸化的MgSO4溶液中加入Ba(OH)2溶液,产生的沉淀质量m与加入的体积V之间的关系,关于下图曲线的推测正确的是( )
A.oa段产生的沉淀为氢氧化镁 B.ab产生段的沉淀为氢氧化镁
C.bc段产生的沉淀为氢氧化镁 D.bc段产生的沉淀为硫酸钡和氢氧化镁
查看答案和解析>>
科目:高中化学 来源: 题型:
用一价离子组成的四种盐溶液:AC、BD、AD、BC,其物质的量浓度均为1 mol/L。在室温下前两种溶液的pH=7,第三种溶液的pH>7,最后一种溶液pH<7,则正确的是( )
| A | B | C | D | |
| 碱性 | AOH>BOH | AOH<BOH | AOH>BOH | AOH<BOH |
| 酸性 | HC>HD | HC>HD | HC<HD | HC<HD |
查看答案和解析>>
科目:高中化学 来源: 题型:
为回收利用废钒催化剂(含有V2O5、VOSO4及不溶性残渣),科研人员最新研制了一种离子交换法回收钒的新工艺,主要流程如下:
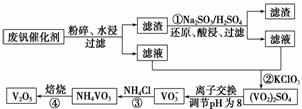
部分含钒物质在水中的溶解性如下:
| 物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
| 溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |
回答下列问题:
(1)工业由V2O5冶炼金属钒常用铝热剂法,写出该反应的化学方程式________________。
(2)图中所示滤液中含钒的主要成分为____________(写化学式)。
(3)用硫酸酸化的H2C2O4溶液滴定(VO2)2SO4溶液,以测定反应②后溶液中含钒量,完成反应的离子方程式为 VO
VO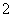 +
+ H2C2O4+
H2C2O4+ ________===
________=== VO2++
VO2++ CO2↑+
CO2↑+ H2O。
H2O。
(4)全钒液流电池的结构如图所示,其电解液中含有钒的不同价态的离子、H+和SO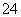 。电池放电时,负极的电极反应为V2+-e-===V3+。
。电池放电时,负极的电极反应为V2+-e-===V3+。
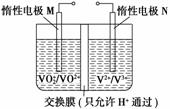
①电池放电时的总反应方程式为__________________。充电时,电极M应接电源的________极;
②若电池初始时左、右两槽内均以VOSO4和H2SO4的混合液为电解液,使用前需先充电激活,充电过程阴极区的反应分两步完成:第一步VO2+转化为V3+;第二步V3+转化为V2+。则第一步反应过程中阴极区溶液n(H+)________(填“增大”、“不变”或“减小”),阳极的电极反应式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
氯化亚铜(CuCl)是重要的化工原料。国家标准规定合格的CuCl产品的主要质量指标为CuCl的质量分数大于96.5%。工业上常通过下列反应制备CuCl:
2CuSO4+Na2SO3+2NaCl+Na2CO3===2CuCl↓+3Na2SO4+CO2↑
(1)CuCl制备过程中需要配制质量分数为20.0%的CuSO4溶液,试计算配制该溶液所需的CuSO4·5H2O与H2O的质量之比。
(2)准确称取所制备的0.250 0 g CuCl样品置于一定量的0.5 mol·L-1FeCl3溶液中,待样品完全溶解后,加水20 mL,用0.100 0 mol·L-1Ce(SO4)2溶液滴定到终点,消耗24.60 mL Ce(SO4)2溶液。有关反应的离子方程式为
Fe3++CuCl===Fe2++Cu2++Cl-
Ce4++Fe2+===Fe3++Ce3+
通过计算说明上述样品中CuCl的质量分数是否符合标准。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com