
【题目】乙二醛(OHC-CHO)是一种重要的精细化工产品。某小组利用乙醛液相硝酸氧化法制备乙二醛并测定乙二醛纯度,装置如图所示:
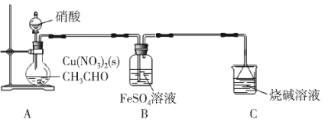
已知:①NO+FeSO4=FeSO4·NO(棕色)。
②几种有机物的部分性质如表所示:
乙醛 | 乙二醛 | 乙二酸 | 乙酸 | |
沸点/℃ | 20.8 | 50.5 | 109 | 117.9 |
溶解性 | 与水、有机溶剂互溶 | 溶于水、乙醇等 | 溶于水和有机溶剂 | 与水、乙醇互溶 |
密度/gcm-3 | 0.78 | 1.27 | 1.90 | 1.05 |
相对分子质量 | 44 | 58 | 90 | 60 |
实验步骤:
①取20 mL乙醛装于烧瓶,加入2 g Cu(NO3)2粉末作催化剂,向烧瓶中缓慢滴加2 mol·L-1硝酸至乙醛完全反应为止;
②提纯产品,最终得到10.0 mL产品。
请回答下列问题:
(1)盛装硝酸的仪器名称是___________。
(2)实验中,观察到装置B中溶液变为棕色,制备乙二醛的化学方程式为________________。
(3)向烧瓶中滴加硝酸要“缓慢”,其目的是___________;判断烧瓶中制备乙二醛的反应已完成的标志是___________。
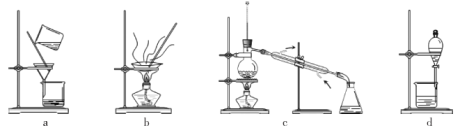
(4)分离提纯产品,宜选择下列装置___________(填字母)。
(5)根据上述实验数据,该实验中乙二醛的产率约为___________(填字母)。
a.56.5% b.61.8% c.67.9% d.72.6%
(6)实验室可用酸性KMnO4溶液测定乙二醛的纯度,发生反应的离子方程式为:18H++6MnO4-+5C2H2O2→10CO2↑+6Mn2++14H2O。实验步骤如下:取V mL产品,加蒸馏水稀释至250 mL,量取25.00 mL稀释后的溶液于锥形瓶,滴加5.00 mL稀硫酸,用c mol·L-1 KMnO4溶液,三次平行实验消耗KMnO4溶液体积如下:
实验 | Ⅰ | Ⅱ | Ⅲ |
V[KmnO4(aq)]/mL | 20.05 | 22.40 | 19.95 |
滴定终点的标志是___________;该产品纯度为___________g·mL-1(用含V和c的代数式表示)。
【答案】分液漏斗 3CH3CHO+4HNO3![]() 3OHC-CHO+4NO↑+5H2O 防止乙二醛被氧化 装置A的烧瓶中不再c产生气泡 c b 当滴入最后一滴KMnO4溶液,溶液由无色变紫红色且半分钟不变色
3OHC-CHO+4NO↑+5H2O 防止乙二醛被氧化 装置A的烧瓶中不再c产生气泡 c b 当滴入最后一滴KMnO4溶液,溶液由无色变紫红色且半分钟不变色 ![]()
【解析】
在Cu(NO3)2催化下,用稀硝酸氧化乙醛制取乙二醛,硝酸被还原为NO;生成的NO会污染空气,用FeSO4溶液吸收NO,根据表中的信息,采用蒸馏的方法提纯乙二醛。
(1)根据装置图可知,盛装硝酸的仪器为分液漏斗。
(2)实验中,观察到装置B中溶液变为棕色,根据信息可知产生FeSO4·NO,说明A装置中生成了NO,故稀硝酸氧化乙醛生成乙二醛,反应的化学方程式为3CH3CHO+4HNO3![]() 3OHC-CHO+4NO↑+5H2O。
3OHC-CHO+4NO↑+5H2O。
(3)如果加入硝酸太快,硝酸氧化产品会生成杂质。NO不溶于水,当装置A中不再产生气泡时,表明装置A中反应已完成。
(4)乙二醛与水互溶,可利用沸点的不同,采用蒸馏的方式分离产品,故答案选c。
(5)根据方程式计算可得,理论上生成乙二醛的质量为0.78×20×![]() g≈20.56g,实际制备乙二醛的质量为1.27
g≈20.56g,实际制备乙二醛的质量为1.27![]() ×10mL=12.7g,产率为
×10mL=12.7g,产率为![]() 。
。
(6)由离子方程式可知,6KMnO4 ~5OHC-CHO,根据实验数据,舍去实验Ⅱ的离群数据,消耗高锰酸钾溶液的平均体积为![]() ,产品纯度为
,产品纯度为
![]()


 优生乐园系列答案
优生乐园系列答案科目:高中化学 来源: 题型:
【题目】某无色溶液中可能含有H+、![]() 、K+、Mg2+、Fe3+、Al3+、Cl-、
、K+、Mg2+、Fe3+、Al3+、Cl-、![]() 、
、![]() 、
、![]() 中的几种离子,且几种阴离子浓度相同(不考虑水的电离)。取三份该溶液于三支试管中,每份10 mL,进行如下操作:
中的几种离子,且几种阴离子浓度相同(不考虑水的电离)。取三份该溶液于三支试管中,每份10 mL,进行如下操作:
①向试管1中滴加足量的BaCl2溶液,过滤后得到沉淀0.03 mol,向滤液中滴加AgNO3溶液有白色沉淀生成。
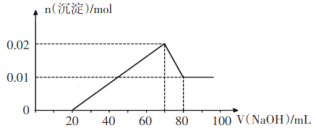
②向试管2中滴加一定浓度的NaOH溶液,产生沉淀的物质的量与NaOH溶液体积关系如图所示。
③向试管3中加入足量铜粉,铜粉溶解并产生无色气体,该气体在试管口处变为红棕色。
则下列说法中正确的是
A.该溶液中一定存在H+、K+、Mg2+、Al3+、Cl-、![]() 、
、![]()
B.该溶液中c(K+)一定为2 mol/L
C.试管2中滴加的NaOH溶液浓度一定为1 mol/L
D.试管3中溶解的铜粉质量一定为0.72 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将SO2通入2L0.01mol·L-1的某一元碱MOH溶液中,溶液中水电离出的OH-的浓度(c)与通入的SO2的体积(V)关系如图所示(不考虑+4价的S被氧化),下列叙述不正确的是
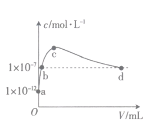
A.MOH为一元强碱
B.b点溶液中:c(H+)=1×10-7mol·L-1
C.c点溶液中:c(M+)=2[c(SO32-))+c(HSO3-)+c(H2SO3)]
D.d点溶液中:c(M+)=2c(SO32-)+c(HSO3-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各反应中属于加成反应的是
A.CH4+2O2![]() CO2+2H2O
CO2+2H2O
B.CH2=CH2+Br2―→CH2Br—CH2Br
C.CH4+Cl2![]() CH3Cl+HCl
CH3Cl+HCl
D.CH3CH2CH2CH3![]() CH2= CH2+CH3—CH3
CH2= CH2+CH3—CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,水的电离达到平衡: H2O![]() H++ OH-ΔH > 0 ,下列叙述正确的是
H++ OH-ΔH > 0 ,下列叙述正确的是
A. 将水加热,Kw增大,pH不变
B. 向水中加入少量盐酸,c(H+)增大,Kw不变
C. 向水中加入NaOH固体,平衡逆向移动,c(OH-) 降低
D. 向水中加入AlCl3固体,平衡逆向移动,c(OH-) 增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温恒容容器中发生N2O4(g)2NO2(g),若反应物的浓度由0.1molL﹣1降到0.06molL﹣1需20s,那么由0.06molL﹣1降到0.036molL﹣1,所需反应时间为( )
A. 10 sB. 12 sC. 大于12 sD. 小于12 s
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是( )
A. 溴水中当加入硝酸银溶液后,溶液颜色变浅 B. 高压比常压有利于工业合成氨反应
C. 红棕色NO2加压后颜色比原来要深 D. 热的纯碱除油污效果好
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在t℃时,某NaOH稀溶液中,c(H+)=10﹣amolL﹣1,c(OH﹣)=10﹣bmolL﹣1,已知a+b=12,则:
(1)该温度下水的离子积常数KW=_______;
(2)该NaOH溶液的物质的量浓度的精确值是______molL﹣1;
(3)在该温度下,将100mL 0.1molL﹣1的稀硫酸与100mL 0.4molL﹣1的NaOH溶液混合后,溶液的pH=______;
(4)该温度下若100体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前 a与b之间应满足的关系是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cr、Co、Al的合金及其相关化合物用途非常广泛。
(1) Cr3+基态核外电子排布式为___________。
(2)1951年Tsao最早报道用LiAlH4还原腈,如反应: 。
。
①LiAlH4中三种元素的电负性从大到小的顺序为___________。
②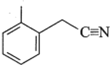 分子中碳原子的轨道杂化类型为__________,1mol该分子中含σ键的物质的量为__________。
分子中碳原子的轨道杂化类型为__________,1mol该分子中含σ键的物质的量为__________。
(3) [Co(15-冠-5)(H2O)2]2+是一种配位离子(“15-冠-5”是指冠醚的环上原子总数为15,其中O原子数为5),请在该配位离子结构示意图(图-1)中的相应位置补画出配位键____________。
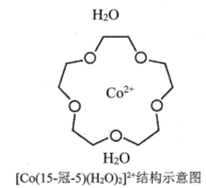 图1
图1
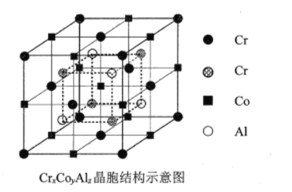 图2
图2
(4)全惠斯勒合金CrxCoyAlz的晶胞结构如题图-2所示,则其化学式为___________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com